
| A. | 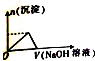 | B. | 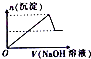 | C. | 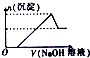 | D. |  |
分析 浓度均为0.1mol•L-1的HNO3、Fe(NO3)3和Al(NO3)3混合溶液中,溶液中氢离子、铁离子、铝离子的浓度相同为0.1mol/L,向混合溶液逐滴加入NaOH溶液,首先氢离子与氢氧根离子反应生成水,然后铁离子、铝离子与氢氧根离子转化为沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,据此结合图象分析.
解答 解:浓度均为0.1mol•L-1的HNO3、Fe(NO3)3和Al(NO3)3混合溶液中,溶液中氢离子、铁离子、铝离子的浓度相同为0.1mol/L,向混合溶液逐滴加入NaOH溶液,首先氢离子与氢氧根离子反应生成水,然后铁离子、铝离子与氢氧根离子转化为沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,沉淀的质量减少,由于氢氧化铁不溶于碱,故沉淀减少到一定值不再变化,最后剩余的沉淀为氢氧化铁沉淀,只有C选项符合;
故答案为:C.
点评 本题考查铝及化合物的性质、化学反应图象等,根据混合溶液中的离子与氢氧根离子反应的先后顺序分析,题目难度不大,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2和NO或NO2中的至少一种 | B. | 肯定只有NO | ||
| C. | 可能有Cl2和O2 | D. | 肯定没有Cl2、O2和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态;Y基态原子的L层有2个未成对电子;Z基态原子的最外层电子排布为3s23p2;Q、R、W都属于金属元素,Q、W基态原子核外均没有未成对电子,R基态原子的d轨道上有3个空轨道.
前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态;Y基态原子的L层有2个未成对电子;Z基态原子的最外层电子排布为3s23p2;Q、R、W都属于金属元素,Q、W基态原子核外均没有未成对电子,R基态原子的d轨道上有3个空轨道.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种.现做如下实验:
有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种.现做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
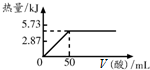 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如下图所示(不考虑热量的散失),则该酸可能是( )
已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如下图所示(不考虑热量的散失),则该酸可能是( )| A. | 醋酸(CH3COOH) | B. | 盐酸 | C. | 草酸(HOOC-COOH) | D. | 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液时的总反应:Ag++3NH3•H20═[Ag(NH3)2]OH+NH4++2H20 | |
| B. | 向1 mL 0.l mol/L硝酸亚铁溶液加入1 mL 0.1 mol/L的HI溶液:3 Fe2++N03-+4H+═3 Fe3++NO+2H2O | |
| C. | 向10 mL 0.lmol/L NH4Al(SO4)2溶液中加入0.1 mol/L Ba(OH)2溶液至恰好只有一种沉淀时:NH4++Al3++5OH-+2 SO42-+2Ba2+═AlO2-+NH3•H2O+2H2O+2BaSO4L | |
| D. | 向高锰酸钾酸性溶液中滴加H202溶液,高锰酸钾溶液紫红色褪去:2MnO4-+7H2O2+6H+═2Mn2++6O2+lOH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3F | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com