
【题目】下列关于原电池的叙述中,正确的是( )
A.原电池的负极上发生还原反应
B.原电池工作时,电子总是由负极经导线流入正极
C.原电池中,正、负极的电极材料一定都是金属单质
D.酸碱中和反应也可以设计成原电池
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铜的相关化合物在生产生活中具有重要的作用。
回答下列问题:
(1)铜元素在周期表中的位置是____,基态铜原子中,核外电子占据最高能层的符号是___,占据该最高能层的电子数为_________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu6Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___(填“晶体”或”非晶体”)。
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为_____。
(SCN)2对应的酸有硫氰酸(H-S-C≡N)、异硫氰酸(H-N=C=S)两种,理论上前者沸点低于后者,其原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子个数为__。
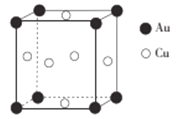
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为anm,该金属互化物的密度为_____________(用含a、NA的代数式表示)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃类有机物在生活和生产中发挥着重要作用,研究它们意义重大。请回答下列问题:
(1)写出乙烷制氯乙烷的方程式______________________________,其反应类型为____________。
(2)写出以乙醇为原料经过两步反应制备乙烯的方程式,并指出第二步反应的反应类型。
第一步:__________________________________;
第二步:______________________,其反应类型为___________________。
(3)0.2mol某烃A在氧气中宋个燃烧后,生成CO2利H2O各1.2mol。若烃A不能使溴水褪色,但在一定条化下能与氯气发生取代反应,其一氯取代物有两种,则烃A的结构简式为___________________。
(4)在一定条件下,某些不饱和烃分子可以进行自身加成反应。例如:
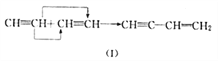
①参照(I)则有机物A![]() ,可由____________(填结构简式)相互加成制取。
,可由____________(填结构简式)相互加成制取。
②参照(I)当两分子丙烯发生自身加成时生成主链为4个碳原子的烃B,则B的结构简式为______,用系统命名法命名B_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。
I.进行如下实验:

请回答:
(1)经Ⅰ得到蓝色溶液,该过程中一定发生的化学反应是(用离子方程式表示)______。
(2)反应II的化学方程式是______________ ,X中一定含有的物质是________。
II.为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。

(3)上述过滤操作如果缺少洗涤步骤,会使得测定的固体质量均_______(填偏大、偏小或无影响)
(4)步骤Ⅳ所得蓝色溶液中阳离子为___________________(5)原混合物中SiO2的质量是___________X中一定不含有的物质是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸
B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为__________________。
(2)第一电离能I1:N____O(填“>”或“<”),第二电离能I2:O大于N的原因是__________________。
(3)O3的空间构型为_________________;是_____________(填“极性”或“非极性”)分子;分子中存在的大π键,可用符号![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H-N、___________、____________ (任写两种即可)。
(5)已知:如下键能和键长数目。
化学键 | 键长/pm | 键能/ |
N-N | 145 | 193 |
N=N | 125 | 418 |
N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________________________。
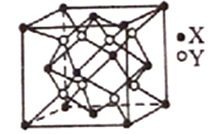
(6)Na2O的晶胞结构如下图所示,X表示O2-,Y表示Na+,则O2-的配位数为_______________,该晶胞的原子空间利用率为_______________;(已知该晶胞的棱长为apm,r(Na+)=xpm,r(O2-)=ypm)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)是无色透明有水果香气的液体,俗称安息香酸乙酯,常用做溶剂和香料。下列说法正确的是( )
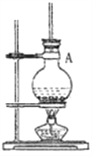
A. 按如图装置制备苯甲酸乙酯,应在烧瓶A中先加入3mL浓H2SO4和4g苯甲酸,然后边振荡烧瓶边慢慢加入10mL乙醇
B. 如图是制备苯甲酸乙酯的简易装置,A中玻璃导管改用球形玲凝管效果更好
C. 制得的苯甲酸乙酯粗产品,可通过水洗、NaOH溶液洗涤、水洗,除去苯甲酸乙酯中的部分杂质
D. 分子式为C9H10O2,含有苯环且能与饱和NaHCO3溶液反应放出气体的有机物共有15种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体重50 kg的健康人含Fe元素约2 g。主要以Fe2+、Fe3+形式存在于人体内。Fe2+易被吸收,给贫血者补充铁,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vc,可使食物中的Fe3+转化为Fe2+。
①人体中经常进行Fe2+![]() Fe3+的转化,在过程A中,Fe2+做_______剂,过程B中Fe3+做______剂。
Fe3+的转化,在过程A中,Fe2+做_______剂,过程B中Fe3+做______剂。
②Vc使Fe3+转化为Fe2+,VC在这一过程中做___________,具有____________性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com