
| A. | ①③④⑥ | B. | ②③④⑤ | C. | ①②③④⑥ | D. | ①②③④⑤ |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是有机物 | B. | Na2CO3是碳酸盐 | ||
| C. | Na2CO3是钠盐 | D. | Na2CO3是易溶性盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个周期和18个族 | |
| B. | 由短周期元素和长周期元素共同组成的族一定是主族 | |
| C. | 从左向右数第13列是第ⅢB族 | |
| D. | 元素周期表中0族元素的单质全部是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2 | B. | CH3CH2CHO | C. | CH3COOH═CH2 | D. | CH3CH(OH)CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(HCl),将混合气体经饱和NaHSO3溶液洗气后干燥 | |
| B. | NaCl溶液(NaOH),加入适量的盐酸 | |
| C. | Na2O2粉末(Na2O),将混合物在氧气中加热 | |
| D. | FeSO4溶液[Fe2(SO4)3],加入适量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
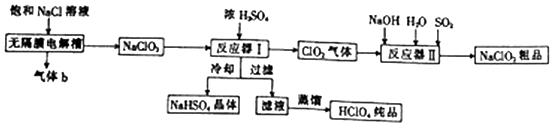
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化银是一种重要的感光材料,是胶卷中的核心成分之一 | |
| B. | 硅晶体是一种重要的半导体材料,还可用于制造光导纤维 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 泥水 | B. | 蒸馏水 | C. | 硫酸铜溶液 | D. | 氢氧化铁胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com