
【题目】下列有关化学反应表达正确的是 ( )
A. 1—丙醇与浓氢溴酸反应:CH3CH2CH2OH + HBr ![]() CH3CH2CH2Br + H2O
CH3CH2CH2Br + H2O
B. 硬脂酸与乙醇的酯化反应:C17H35COOH + C2H518OH ![]() C17H35COOC2H5 + H218O
C17H35COOC2H5 + H218O
C. 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH + OH— ![]() CH2BrCOO— + H2O
CH2BrCOO— + H2O
D. 向丙氨酸钠中加入足量盐酸: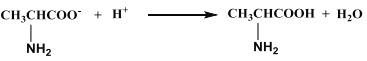
【答案】A
【解析】本题考查有机化学方程式的书写。
A.二者发生取代反应生成1-溴丙烷和水;B.硬脂酸与乙醇发生酯化反应时,羧酸去掉羧基上羟基,醇去掉羟基上氢原子;C.CH2BrCOOH中的溴原子和羧基均能与氢氧化钠溶液反应;D.丙氨酸钠中—COO—和氨基均与盐酸反应。
1-丙醇与浓氢溴酸发生取代反应,反应的化学方程式为:CH3CH2CH2OH+HBr ![]() CH3CH2CH2Br+H2O,A正确;C17H35COOH 与 C2H518OH在浓硫酸作用下,共热发生酯化反应生成C17H35CO18O C2H5,反应的化学方程式为:C17H35COOH + C2H518OH
CH3CH2CH2Br+H2O,A正确;C17H35COOH 与 C2H518OH在浓硫酸作用下,共热发生酯化反应生成C17H35CO18O C2H5,反应的化学方程式为:C17H35COOH + C2H518OH ![]() C17H35CO18OC2H5 + H2O,B错误;向CH2BrCOOH中加入足量的氢氧化钠溶液并加热,羧基和氢氧化钠发生中和反应,溴原子在碱中发生水解反应,反应的化学方程式为:CH2BrCOOH +2 OH—
C17H35CO18OC2H5 + H2O,B错误;向CH2BrCOOH中加入足量的氢氧化钠溶液并加热,羧基和氢氧化钠发生中和反应,溴原子在碱中发生水解反应,反应的化学方程式为:CH2BrCOOH +2 OH— ![]() CH2(OH)COO— + H2O,C错误;向丙氨酸钠中加入足量盐酸,—COO—和盐酸反应生成—COOH,氨基与盐酸反应生成—NH3+,反应的化学方程式为:
CH2(OH)COO— + H2O,C错误;向丙氨酸钠中加入足量盐酸,—COO—和盐酸反应生成—COOH,氨基与盐酸反应生成—NH3+,反应的化学方程式为: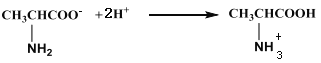 ,D错误。
,D错误。
故选A。


科目:高中化学 来源: 题型:
【题目】将足量的二氧化锰与40ml 10mol/L浓盐酸反应产生的氯气,同0.1mol二氧化锰与足量的浓盐酸反应产生的氯气相比
A.前者产生的氯气多 B.一样多
C.后者产生的氯气多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米金(79Au)粒子在遗传免疫等方面有重大的应用前景,下列说法错误的是
A.Au为第六周期元素B.Au为黑色金属
C.Au的质子数为79D.纳米金表面积大吸附能力强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1ml,滴定过程中发生的一个反应为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为_________________。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用_________。
a.普通漏斗和滤纸 b.布氏漏斗和滤纸 c.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因_____而导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是__________________。
(4)KMnO4标准液滴定H2O2的离子方程式为___________________;当滴定到______________可以认为已达到滴定终点。
(5)该医用消毒剂中H2O2的物质的量浓度为_______________mol·L-1。
(6)②中若用盐酸代替H2SO4,测定结果将___________(填“偏高”“ 偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,同时又是吸热反应的是( )
A. Ba(OH)2·8H2O与NH4Cl反应 B. 灼热的炭与CO2反应
C. 铝与稀盐酸 D. H2与O2的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氮氧化物、②未完全燃烧的碳氢化合物、③含铅化合物、④二氧化硫、⑤一氧化碳,其中属于汽车尾气成分的是( )
A.①②③④
B.①②③⑤
C.②③④⑤
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

(1)氢氧燃料电池的在导线中电流的方向为由______(用a、b表示)。
(2)负极反应式为______,正极反应式为___________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ 2Li+H2![]() 2LiH Ⅱ LiH+H2O=LiOH+H2↑
2LiH Ⅱ LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是_________,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g·cm-3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为______。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com