
| A. | D2O呈中性,PD=7 | |
| B. | 1LD2O溶液中含0.01molNaOD,PD=12 | |
| C. | 用D2O溶解0.1molDCl成1L溶液,PD=2 | |
| D. | 在100ml0.25mol/LDCl溶液中加入50ml0.2mol/L的NaOD的D2O溶液,PD=1 |
分析 A.某温度下重水D2O的离子积为1.6×10-15,则纯重水中c(D+)=4×10-8mol/L,pD=-lg(D+);
B.1LD2O溶液中含0.01molNaOD,c(OD-)=10-2mol/L,根据c(D+)•c(OD-)=1.6×10-15,求c(D+)以及PD;
C.根据 pD=-lgc(D+),带入c(D+)=0.1mol/L进行求算;
D.先算出n(DC)、n(NaOD)的物质的量,判断反应后溶液酸碱性,在进行求算溶液的pD.
解答 解:A.某温度下重水D2O的离子积为1.6×10-15,则纯重水中c(D+)=4×10-8mol/L,pD=-lg(D+)=-lg4×10-8=8-lg4=7.4>7,故A错误;
B.在D2O中溶解0.01mol NaOD得到溶液的体积为1L,则为0.01mol/LNaOD的D2O溶液,重水(D2O)的离子积为c(D+)•c(OD-)=1.6×10-15,c(D+)=$\frac{1.6×1{0}^{-15}}{0.01}$=1.6×1O-13,与pD=12,c(D+)=1×1O-12 mol/L矛盾,故B错误;
C.0.1mol DCl(设溶液的体积为1L),c(D+)=0.1mol/L,pD=-lgc(D+),把c(D+)=0.1mol/L代入后可以求得pD=-lgc(D+)=-lg10-1=1,故C错误;
D.n(DCl)=0.25mol/L×0.1L=0.025mol,n(NaOD)=0.2mol/L×0.05L=0.01mol,则酸过量,混合溶液中C(DCl)=$\frac{0.25mol/L×0.1L-0.2mol/L×0.05L}{0.15L}$=0.1mol/L,则C(D+)=0.1mol/L,PD=1,故D正确;
故选D.
点评 本题以离子积常数为载体考查pH的有关计算,正确计算溶液中c(D+)是解本题关键,采用知识迁移方法计算溶液的pD,注意该温度下离子积常数不是1.0×10-14,为易错点,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 欲检验某溶液中含有Fe2+,先向该溶液中加氯水,再加硫氰化钾 | |
| B. | 常温下,铝罐可以用于盛装浓硝酸,利用了浓硝酸的酸性 | |
| C. | Na2O2与水反应可用于制O2,其中Na2O2既做氧化剂又做还原剂 | |
| D. | 可用HF刻蚀玻璃,是因为玻璃中含有的SiO2具有酸性氧化物的通性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为283 kJ | |
| B. | 两个反应都只发生了共价键的断裂和形成 | |
| C. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1023 | |
| D. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509 kJ/mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑦ | B. | ①②③④⑤⑦ | C. | ①②③④⑥ | D. | ①④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
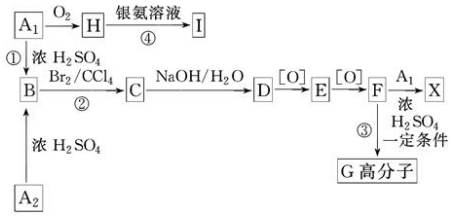
 .
. .
. .
. 、
、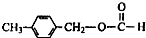
 、
、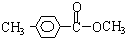 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw 减小 | |
| B. | 将水加热,Kw增大,pH<7 | |
| C. | 向水中通入少量HCl气体,平衡逆向移动,c(H+ )降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+ )和Kw 均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | CO(g)燃烧热283.0 kJ•mol-1,2CO2(g)═2CO(g)+O2(g)的△H=+2×283.0 kJ•mol-1 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液:H+、Al3+、NH4+、NO3-、K+ | |
| B. | FeCl3溶液中:K+、Na+、SCN-、Cl- | |
| C. | 能使淀粉KI试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- | |
| D. | 含有0.1 mol•L-1 HCO3-的溶液:Na+、Fe3+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com