
【题目】中国科学家屠呦呦因青蒿素的研究荣获了2015年诺贝尔化学奖。青蒿素是继乙氨嘧啶、氯喹、伯喹之后最有效的抗疟特效药,具有速效和低毒的特点,曾被世界卫生组织称做是―世界上唯一有效的疟疾治疗药物‖。由青蒿素合成系列衍生物(它们的名称和代号如图所示)的路线如图:

回答下列问题:
(1)青蒿素的分子式为________;氢化青蒿素分子中官能团名称为______________。
(2)反应①中,有机反应类型为___________;NaBH4的作用是_______________。
A.氧化剂 B.还原剂 C.催化剂 D.溶剂
(3)有机物 D 是分子式为 C4H4O 3的五元环状化合物,请写出反应③的化学反应方程式
______________________________________________________。
(4)青蒿唬酯能够发生的反应类型有________。
A.酯化反应 B.水解反应 C.还原反应 D.加聚反应
(5)以H2Q 表示双氢青蒿素,写出反应②的化学方程式____________________________。
(6)从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物 E。合成过程中,有机原料除H2Q、![]() 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH 溶液反应的离子反应方程式_____________________________________________,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有 4 种不同类型的氢,其个数比为3︰2︰2︰1,则符合条件的有机物G的同分异构体有_____种。
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH 溶液反应的离子反应方程式_____________________________________________,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有 4 种不同类型的氢,其个数比为3︰2︰2︰1,则符合条件的有机物G的同分异构体有_____种。
【答案】(1)C15H22O5; 醚键,酯基;
(2)加成反应(或还原反应); B;
(3) ;
;
(4)ABC;
(5)H2Q+CH3OH![]() HQ-CH3+H2O;
HQ-CH3+H2O;
(6)![]() ;3;
;3;
【解析】试题分析:(1)有机物的线键式中的端点、转折点均为碳原子,每个碳原子有4 个价键,不足的用H 原子补充,每个氧原子2个价键,可确定青蒿素的分子式为C15H22O5,氢化青蒿素分子中官能团名称为醚键、酯基。
(2)通过比较有机物的结构可知,反应①的过程中青蒿素中的酯基中的碳氧双键发生了加氢反应,青蒿素转化为双氢青蒿素,所以反应①的有机反应类型为加成反应(或还原反应) ;NaBH4的作用是还原剂。
(3)通过比较有机物的结构可知,反应③是双氢青蒿素分子中的醇羟基与有机物 D发生反应生成了酯,再根据有机物D是分子式为C4H4O3的五元环状化合物可知,有机物D的结构简式为![]() ,所以反应③的方程式为
,所以反应③的方程式为![]() 。
。
(4)青蒿唬酯中含有的官能团有过氧键、醚键、酯基和羧基,能发生酯化、水解和还原反应,不含碳碳双键,不能发生加聚反应。
(5)通过比较有机物的结构可知,反应②可看成是双氢青蒿素分子中的醇羟基与甲醇 反 应 生 成 醚 和 水,以H2Q 表示双氢青蒿素, 反应的方程式为H2Q+CH3OH![]() HQ-CH3+H2O 。
HQ-CH3+H2O 。
(6)根据合成E 的过程中,有机原料除H2Q、![]() 外,还需含苯环的二羟基化合物F ,与E 的结构简式进行比较可知,F的结构简式为
外,还需含苯环的二羟基化合物F ,与E 的结构简式进行比较可知,F的结构简式为![]() ,F 分子中含有1 个酚 羟 基 , 能 与 NaOH溶液反应 , 反 应的离子 方 程 式 为
,F 分子中含有1 个酚 羟 基 , 能 与 NaOH溶液反应 , 反 应的离子 方 程 式 为![]() 。符合条件的有机物 G 的同分异构体有3种,其结构简式分别
。符合条件的有机物 G 的同分异构体有3种,其结构简式分别![]() 。
。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】已知乳酸的结构简式为 。试回答:
。试回答:
(1)乳酸分子中含有________和_________两种官能团(写名称)。
(2)乳酸与金属钠反应的化学方程式为______________________________________________。
(3)乳酸与Na2CO3溶液反应的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——物质结构与性质】
氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是________。前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________________________
(3)N2F2分子中N原子的杂化方式是___________________,l mol N2F2含有______mol![]() 键。
键。
(4)NF3的键角______NH3的键角(填“<”“>”或“=”),原因是__________________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。l mol NH4BF4_________mol配位键。
(6)安全气囊的设计原理为6NaN3+FeIO3![]() Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑

①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质。写出两种与N3-互为等电子体的分子或离子____________。
②Na2O的晶胞结构如图所示,品胞边长为566pm,晶胞中氧原子的配位数为_____,Na2O晶体的密度为_____g·cm-3(只要求列算式,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇和乙酸是生活中两种常见的有机物。请回答下列问题:
(1)乙醇的结构简式为CH3CH2OH,乙醇分子含有的官能团为 ;
(2)生活中常用食醋除去暖瓶内的水垢(主要成分是CaCO3),反应的化学方程式为2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O。通过这个事实,你得出醋酸与碳酸的酸性强弱关系是:醋酸 碳酸(填“>”或“<”);
(3)在浓硫酸的催化作用下,加热乙酸和乙醇的混合溶液,可发生酯化反应。请完成化学方程式:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ 。
CH3COOCH2CH3+ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石蜡油(主要是含17个碳原子以上的液态烷烃混合物)分解实验按照右图进行:
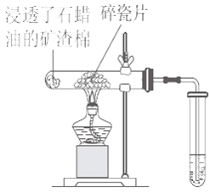
(1)石蜡油分解实验产生的气体的主要成分是 (填写序号)。
①只有甲烷 ②只有乙烯 ③烷烃跟烯烃的混合物。
(2)将石蜡油分解所得生成物通入到酸性高锰酸钾溶液中,现象是 。
(3)碎瓷片的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下面的元素周期表,并回答下列问题

(1)在上面元素周期表中,全部是金属元素的区域为 。
甲 乙 丙 丁
(2)用实线画出金属与非金属的分界线。(在答题卷图上完成)
(3)请问:仅用①②④三种元素 (填“能”或“不能”)形成离子化合物;若能,请写出该物质的名称_________(若不能,此格不填)
若用球棍模型表示①和③形成的化合物的分子结构,应该是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A. 由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B. 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C. 达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D. 压强为0.50 MPa时,不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分。用化学式或元素符号回答下列问题:
IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是__________(填元素名称)。
(2)三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)在室温下有颜色的气体单质溶于水的离子方程式为_____ __;
(4)⑧与⑨分别与H2形成的氢化物的稳定性:__________,(用化学式表示)最高价氧化物对应的水溶液的酸性由强到弱的顺序:______ _________。(用化学式)
(5)①③⑤单质的活泼性顺序为_____>____>____(填元素符号),判断的实验依据是__(写出一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种前四周期的元素。A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态。C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8。E位于周期表第12纵列且是六种元素中原子序数最大的。R是由D、E形成的化合物,其晶胞结构如图所示。请回答下列问题:

(1)C元素的电负性___D元素的电负性(填“>”、“<”或“=”)。
(2)C的第一电离能比它同周期前一族相邻元素的第一电离能________
(填“大”或“小”)。
(3)E的价电子排布式为_______ _,该元素位于周期表中__ _族。
(4)化合物A2D的电子式为______________________。
(5)D和B形成的一种化合物D2B2广泛用于橡胶工业,它的分子结构与双氧水相似,但在该化合物分子中,所有原子最外层均满足8电子稳定结构。则D2B2分子中D原子的杂化类型是__________,D2B2是_________分子(填“极性”或“非极性”)。
(6)R的化学式为________________(用元素符号表示)。已知R晶体的密度为ρ g·cm-3,则该晶胞的边长a=_____________ cm,(阿伏加德罗常数用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com