
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2悬浊液 | 金属钠 | |
| A | 中和反应 | - | 溶解 | 产生氢气 |
| B | - | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| C | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | - |
| D | 水解反应 | - | - | - |
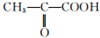 ),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.
),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.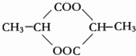 .
. 分析 (1)A能发生中和反应且能溶解氢氧化铜悬浊液,能和钠反应生成氢气,说明含有羧基,且不含甲基,则A为丙酸;
B.能发生银镜反应、能和新制氢氧化铜悬浊液发生氧化反应,说明含有醛基,能和钠反应生成氢气,根据O原子个数知,还含有醇羟基,含有甲基,则B为2-羟基丙醛;
C.能发生水解反应说明含有酯基,能发生银镜反应、能和新制氢氧化铜悬浊液发生氧化反应,说明含有醛基,则C为甲酸乙酯;
D.能发生水解反应说明含有酯基,不能发生银镜反应说明不含醛基,且含有甲基,在D为乙酸甲酯;
(2)9g乳酸物质的量=$\frac{9g}{90g/mol}$=0.1mol,生成氢气物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,乙醇能和乳酸反应生成酯,说明含有羧基,因为0.1mol乳酸能和足量钠反应生成0.1mol氢气,说明乳酸中还含有一个-OH,乳酸在Cu作催化剂时可被氧化成丙酮酸(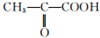 ),则弱酸中醇羟基位于中间碳原子上;
),则弱酸中醇羟基位于中间碳原子上;
(3)两个乳酸分子在一定条件下脱水生成环酯(C6H8O4),其结构简式为 .
.
解答 解:(1)A能发生中和反应且能溶解氢氧化铜悬浊液,能和钠反应生成氢气,说明含有羧基,且不含甲基,则A为CH3CH2COOH;
B.能发生银镜反应、能和新制氢氧化铜悬浊液发生氧化反应,说明含有醛基,能和钠反应生成氢气,根据O原子个数知,还含有醇羟基,含有甲基,则B为CH3CH(OH)CHO;
C.能发生水解反应说明含有酯基,能发生银镜反应、能和新制氢氧化铜悬浊液发生氧化反应,说明含有醛基,则C为HCOOCH2CH3;
D.能发生水解反应说明含有酯基,不能发生银镜反应说明不含醛基,且含有甲基,在D为CH3COOCH3;
故答案为:CH3CH2COOH;CH3CH(OH)CHO;HCOOCH2CH3;CH3COOCH3;
(2)9g乳酸物质的量=$\frac{9g}{90g/mol}$=0.1mol,生成氢气物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,乙醇能和乳酸反应生成酯,说明含有羧基,因为0.1mol乳酸能和足量钠反应生成0.1mol氢气,说明乳酸中还含有一个-OH,乳酸在Cu作催化剂时可被氧化成丙酮酸(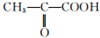 ),则弱酸中醇羟基位于中间碳原子上,其结构简式为CH3CH(OH)COOH,故答案为:CH3CH(OH)COOH;
),则弱酸中醇羟基位于中间碳原子上,其结构简式为CH3CH(OH)COOH,故答案为:CH3CH(OH)COOH;
(3)两个乳酸分子在一定条件下脱水生成环酯(C6H8O4),其结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物推断及有机物结构式的判断,侧重考查学生分析推断能力,明确官能团及其性质关系是解本题关键,注意甲酸、甲酸某酯都能发生银镜反应,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
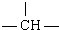 一个-OH,其余为甲基,则甲基个数为( )
一个-OH,其余为甲基,则甲基个数为( )| A. | 2n+3m-1 | B. | m+n-1 | C. | n+2m+1 | D. | n+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
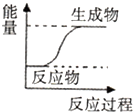
| A. | C+C02 $\frac{\underline{\;高温\;}}{\;}$2CO | B. | Zn+H2S04=ZnS04+H2↑ | ||
| C. | CH4+202$\stackrel{点燃}{→}$C02+2H20 | D. | K0H+HN03=KN03+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH5的电子式: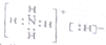 | |
| B. | NH5中N元素的化合价为+5价 | |
| C. | 1molNH5中含有5molN-H键 | |
| D. | 1molNH5与H2O完全反应,转移电子2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
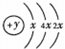 ,B、C可形成离子化合物B3C2,E是同周期元素中原子半径最小的元素.
,B、C可形成离子化合物B3C2,E是同周期元素中原子半径最小的元素. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:D>C>B,第一电离能:C>D>B,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出H2.G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍.
已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:D>C>B,第一电离能:C>D>B,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出H2.G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍.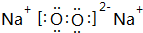 .它与F2D3按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为2Na2O2+2Al2O3=4NaAlO2+O2↑.
.它与F2D3按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为2Na2O2+2Al2O3=4NaAlO2+O2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com