
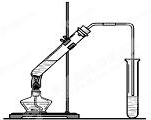
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、一定浓度的盐酸 | 饱和Na2CO3溶液 | 1.2 |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
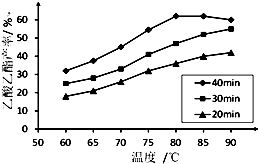 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 502 | 4 600 | 6 900 | 9 500 |
| Y | 588 | 1 820 | 2 750 | 11 600 |
| A、元素X的常见化合价是+1 |
| B、若元素Y处于第3周期,它可与冷水剧烈反应 |
| C、元素Y是ⅢA族元素 |
| D、元素X与氯形成化合物时,化学式可能是XCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| B、在熔融状态下,lmol NaHSO4完全电离出的阳离子数为2NA |
| C、5.6 g铁粉在2.24L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA |
| D、78g Na2O2固体与H2O完全反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
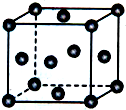 已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.
已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| SO | 2- 4 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
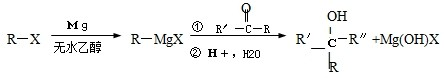
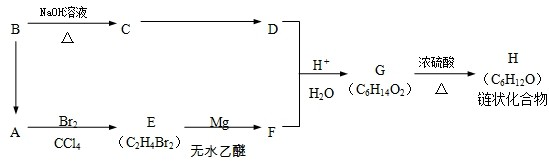
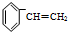 )聚合而成,是一种多功能塑料,广泛应用于食品包装,机器设备等许多日常生活领域中.写出以D和苯为主要原料制备苯乙烯(
)聚合而成,是一种多功能塑料,广泛应用于食品包装,机器设备等许多日常生活领域中.写出以D和苯为主要原料制备苯乙烯(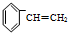 )的合成路线流程图,无机试剂任选.(合成路线常用表示方法为:A
)的合成路线流程图,无机试剂任选.(合成路线常用表示方法为:A| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com