
| A. | Na+、HS-、H+、Cl- | B. | HS-、Na+、OH-、K+ | ||
| C. | K+、CO32-、Br-、AlO2- | D. | H+、Cl-、Na+、SO32- |
分析 A.氢离子与硫氢根离子反应生成硫化氢气体;
B.硫氢根离子与氢氧根离子反应生成硫离子和水;
C.四种离子之间不发生反应,能够共存;
D.氢离子与亚硫酸根离子反应.
解答 解:A.HS-、H+之间反应生成硫化氢,在溶液中不能大量共存,故A错误;
B.HS-、OH-之间发生反应,在溶液中不能大量共存,故B错误;
C.K+、CO32-、Br-、AlO2-之间不反应,在溶液中能够大量共存,故C正确;
D.SO32-和H+发生反应,在溶液中不能共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等,试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA | |
| B. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA | |
| D. | 1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:3:5 | B. | 5:1:3 | C. | 3:1:5 | D. | 2:4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
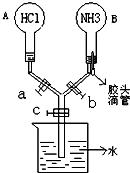 如图所示的装置,实验前a、b、c活塞均关闭.
如图所示的装置,实验前a、b、c活塞均关闭.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{125}I$是碘的一种核素 | |
| B. | ${\;}_{53}^{125}I$核内的中子数与核外电子数之差为19 | |
| C. | ${\;}_{53}^{125}I$质量数为l25 | |
| D. | ${\;}_{53}^{125}I$是一种新发现的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O | |
| B. | 硫酸铝溶液与足量烧碱:Al3++3OH-=Al(OH)3↓ | |
| C. | 氯化亚铁溶液中滴入氯水Cl2+2Fe2+═2Cl-+2Fe3+ | |
| D. | 金属铝投入NaOH溶液中2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2所含有的离子数为3NA | |
| B. | 1mol甲基中含有电子数为10NA | |
| C. | 7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA | |
| D. | 1molC10H22分子中共价键总数为22NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2S溶液中加入少量FeCl3溶液:2Fe3++S2-═2Fe2++S↓ | |
| B. | 向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O═SO42-+Cl-+2H+ | |
| D. | Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: +CO32-→ +CO32-→ +HCO3- +HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com