
| A. | 利用布朗运动可区别溶液和胶体 | |
| B. | 溶液中通过一束光线时没有明显现象,胶体中通过一束光线时出现明显的光路 | |
| C. | 胶体微粒带电荷,溶液中溶质微粒不带电荷 | |
| D. | 制备Fe(OH)3胶体的方法是:将饱和FeCl3溶液通入热的NaOH溶液中并持续煮沸 |
分析 A.悬浮微粒永不停息地做无规则运动的现象叫做布朗运动;
B.丁达尔现象是胶体的特征性质,溶液没有;
C.溶液和胶体中的粒子都可能带电或不带电;
D.氢氧化钠和氯化铁反应生成的是氢氧化铁的沉淀.
解答 解:A.悬浮微粒永不停息地做无规则运动的现象叫做布朗运动,布朗运动是分散系中共同的性质,无法鉴别,故A错误;
B.溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明显光路,故B正确;
C.氯化钠溶液中,钠离子和氯离子带电,故C错误;
D.NaOH溶液中滴加FeCl3饱和溶液生成的是氢氧化铁的沉淀,氢氧化铁胶体的制备是将饱和的氯化铁溶液滴加到沸水中,故D错误.
故选B.
点评 本题考查胶体的性质和制备,题目难度不大,注意氢氧化铁胶体的制备是将饱和的氯化铁溶液滴加到沸水中.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
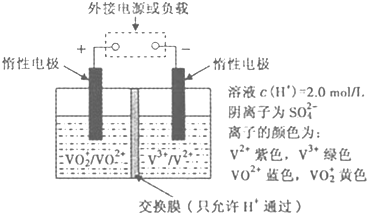
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
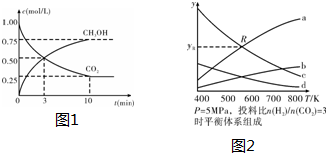
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量C02通入氢氧化钙溶液中:CO2+OH-═HCO3- | |
| B. | Na202加入H2180中:2Na2O2+2H218O═4Na++4OH-+18O2↑ | |
| C. | 硅与氢氟酸的反应:Si+4H++4F-═SiF4↑+2H2↑ | |
| D. | 水玻璃中通人过量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO32-+H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H 2(g)+O 2(g)═2H 2O(g);△H=-483.6KJ•mol -1,则氢气的燃烧热为241.8kJ•mol -1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H 2O(1);△H=-57.4kJ•mol -1则含 20.0gNaOH的稀溶液与稀醋酸完全中和,放出小于28.7kJ的热量 | |
| C. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| D. | 己知2C(s)+2O 2(g)═2CO 2(g);△H=akJ•mol -1、2C(s)+O 2(g)═2CO(g);△H=bkJ•mol -1,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com