
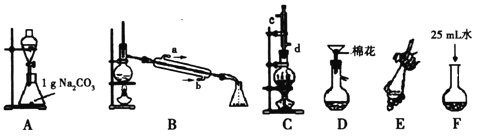
【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。
有关数据如下表:
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | -97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是__________________________________,在实际实验中,甲醇、苯甲酸的物质的量之比远大于理论上物质的量之比,目的是_______________。装置C中除甲醇、苯甲酸与浓硫酸外还需要放置____________________________。
(2)B装置需加热的玻璃仪器的名称__________,C装置上部的冷凝管的主要作用是_____________________。冷却剂在冷凝管中的流动方向是__________。
(3)制备和提纯苯甲酸甲酯的操作先后顺序为(填装置字母代号)________________。
(4)A中Na2CO3的作用是_____________________;D装置的作用是_______________;当B装置中温度计显示_____________℃时可收集苯甲酸甲酯。
【答案】 先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸 提高苯甲酸的利用率 沸石或碎瓷片 蒸馏烧瓶 冷凝回流、导气 从d口进、C口流出 CFEADB 除去酯中的苯甲酸 除未反应完的Na2CO3 199.6
【解析】(1)参考浓硫酸的稀释,先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸来配制混合液,通过增加甲醇的量,提高苯甲酸的转化率,给液体混合物加热时通常添加沸石防暴沸;
(2)B装置需加热的玻璃仪器的名称为蒸馏烧瓶,C装置上部的冷凝管可使反应混合加热时挥发出的蒸汽经冷凝重新回流反应容器中,减少原料的损耗,冷却水的水流方向与蒸汽的流向相反,选择从d口进入,c口流出;
(3)在圆底烧瓶中加入0.1mol苯甲酸和0.4mol甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品;苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,需进行分液、蒸馏等操作,可用分液的方法除去苯甲酸甲酯中的硫酸、苯甲酸,然后进行蒸馏,操作的顺序为CFEADB;
(4)碳酸钠用于洗去苯甲酸甲酯中过量的酸,过量的碳酸钠用过滤的方法可除去,蒸馏时,将苯甲酸甲酯与甲醇、水分离,由苯甲酸甲酯的沸点可知应收集沸点199.6℃的馏分,故应控制温度199.6℃。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】记住酸碱盐的溶解性对书写离子方程式很有帮助。下列物质中难溶于水的是:
A. FeSO4 B. CaCl2 C. H2SiO3 D. NaClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+的物质的量浓度为0.5 molL1的某澄清溶液中,还可能含有如下离子:K+、Mg2+、Ba2+、![]() 、
、![]() 、
、![]() 。取100 mL该溶液进行如下实验(气体体积在标准状况下测定):
。取100 mL该溶液进行如下实验(气体体积在标准状况下测定):
I.向该溶液中加入足量稀盐酸,在标准状况下放出0.56 L气体(不考虑气体溶解);
II.向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33 g;
下列说法正确的是
A.一定不存在的离子是Mg2+、Ba2+,不能确定是否含有K+、![]()
B.一定存在的离子是![]() 、
、![]() ,
,![]() 的物质的量浓度为0.25 molL1,
的物质的量浓度为0.25 molL1,![]() 的物质的量浓度为0.1 molL1
的物质的量浓度为0.1 molL1
C.一定存在的离子是![]() 、
、![]() 、K+,其中K+浓度≥0.2 molL1
、K+,其中K+浓度≥0.2 molL1
D.一定存在的离子是![]() 、
、![]() 、K+,其中K+浓度为0.2 molL1
、K+,其中K+浓度为0.2 molL1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中正确的是
A.铜锌原电池中铜是负极B.在铁上电镀铜时用铜作阴极
C.用电解法精炼粗铜时纯铜作阴极D.电解稀硫酸时用铜作阳极,阳极产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015·北京]某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH=== Cl+ ClO+ H2O
B.该消毒液的pH约为12:ClO+ H2O![]() HClO+ OH
HClO+ OH
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl+ ClO=== Cl2 ↑+ H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO===HClO+ CH3COO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:
![]()
(1)Co2+基态核外电子排布式为 。
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。
(3)与NO2-互为等电子体的单质分子为 (写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。

(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有σ键的数目为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟号”载人航天器中宇航员所在的轨道和返回仓都是密封的,宇航员吸入氧气、呼出二氧化碳,如果二氧化碳浓度过高,会使宇航员困乏,呼吸频率加快,严重的还会窒息,为解决此问题,应在航天仓中加入( )
A. Na2O2 B. Na2CO3 C. NaOH D. 高压氧气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·江苏]制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.通入过量Cl2:Fe2+、H+、![]() 、Cl、
、Cl、![]()
B.加入少量NaClO溶液:![]() 、Fe2+、H+、
、Fe2+、H+、![]() 、ClO
、ClO
C.加入过量NaOH溶液:Na+、Fe2+、![]() 、
、![]() 、OH
、OH
D.加入过量NaClO和NaOH的混合溶液:Na+、![]() 、Cl、ClO、OH
、Cl、ClO、OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com