
【题目】常温常压下,将下列各组气体分别充入到容积可变的密闭容器中,充分反应后,体积由大到小的顺序是
①2molNH3和1molHCl,②2molSO2和1molO2,③2molH2S和1molSO2,④2molNO和1molO2,⑤1molH2和1mol Cl2
A. ②>④>⑤>①>③
B. ②>⑤>④>①>③
C. ④>②=⑤>③>①
D. ④=⑤>②>③>①
【答案】B
【解析】
①因NH3与HCl发生反应:NH3+HCl=NH4Cl,NH3过量,剩余气体的物质的量为1mol;
②因SO2与O2在常温常压下很难发生,密闭容器中气体为SO2、O2,气体的总的物质的量为3mol;
③因H2S和SO2发生反应:2H2S+SO2=3S+2H2O,两者恰好反应,S为固体,H2O为液体,密闭容器中没有气体;
④因NO和O2发生反应:2NO+O2=2NO2,两者恰好反应,而NO2还能转变成N2O4:2NO2![]() N2O4,密闭容器中气体有NO2和N2O4,物质的量大于1mol小于2mol;
N2O4,密闭容器中气体有NO2和N2O4,物质的量大于1mol小于2mol;
⑤因H2和Cl2在常温常压下不反应,密闭容器中气体有H2和Cl2,物质的量为2mol;
因此,体积由大到小的顺序:②>⑤>④>①>③。
故选B。


科目:高中化学 来源: 题型:
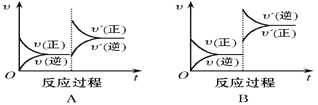
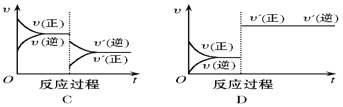
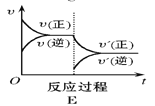
【题目】在一定条件下,反应A(g)+B(g) C(g),H < 0,达到平衡后,根据下列图像判断:
(1)升温,达到新的平衡的是(___________);
(2)降压,达到新的平衡的是(______________);
(3)减少C的量,移向新平衡的是(_____________) ;
(4)增加A的量,移向新平衡的是(____________),此时B的转化率___________(填“增大”或“减小”或“不变”,下空同);
(5)使用催化剂,达到平衡的是(_______________),C的质量分数_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程。请回答下列问题。

(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是________。
(3)操作Ⅰ的名称为____,简述利用“操作Ⅰ”的装置洗涤难溶物的实验操作________。
(4)化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1︰2反应可生成Cl-和一种阳离子________的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是________。
(5)常温时N2H4·H2O(水合肼)在碱性条件下能还原(4)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到________g的单质Ag。
(6)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为________,负极的产物有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是
的物质的量随时间变化的曲线如图所示。下列判断正确的是
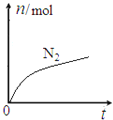
A. 该反应的氧化剂ClO-,还原产物是![]() B. 消耗1mol还原剂,转移6mol电子
B. 消耗1mol还原剂,转移6mol电子
C. 水是生成物,且反应后溶液的酸性明显增强 D. 氧化剂与还原剂的物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在某一化学反应中,反应物B的浓度在5s内从2.0mol/L变成0.5mol/L,在这5s 内B的化学反应速率为多少______?
(2)一个5L的容器中,盛入8.0mol某气体反应物,5min后,测得这种气体反应物还剩余 6.8mol,这种反应物的化学反应速率为多少_________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
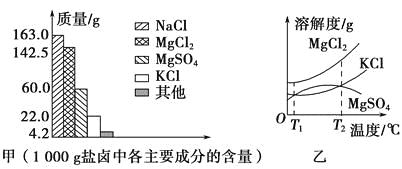
【题目】我国拥有很长的海岸线,具有丰富的海洋资源,以海水为原料的盐化工是我国重要的产业。盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如下图甲)。盐卤在食品、化工等方面具有广泛的用途。请解答下列与盐卤有关的试题。
(1)根据图甲,写出盐卤中含量最多的两种盐的化学式:_______、_______。
(2)下图乙是盐卤中某些物质的溶解度曲线,已知T1℃时,MgSO4和KCl的溶解度分别为M、N,则它们溶解度大小的关系为_______;将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是______________________________________________________。
(3)化工厂利用卤水生产金属镁的工艺流程如下:
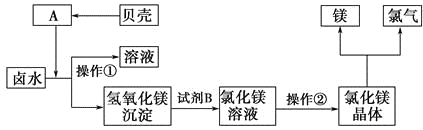
“操作①”的目的是将氢氧化镁沉淀分离出来,操作①的名称是_______。氢氧化镁与试剂B反应的化学方程式为______________________________。
操作②的名称是_______。该方法的优点为___________________________。
(4)用电解法制备金属镁,两位同学分别设计了下面的两种方法。
甲:电解氯化镁溶液。
乙:电解熔融的氯化镁。
其中同学_______(填“甲”或“乙”)能够成功地制备金属镁,假设生产过程中镁元素没有损失,则100 g卤水可制备镁_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图流程可制备1,4-环己二醇,试回答:
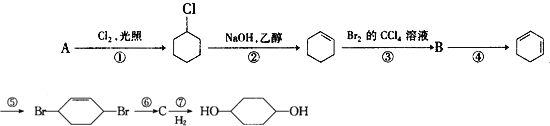
(1)反应①、②、③分别属于___、____、___。(填反应类型)
(2)化合物![]() 中所含官能团的名称为_______和________。
中所含官能团的名称为_______和________。
(3)写出下列化合物的结构简式:A_________,C________。
(4)反应④所用的试剂和条件为_________________。
(5)写出下列反应的化学方程式:反应①_____________;反应④_______________。
(6)请写出以CH3CH2Br为原料制备HOCH2CH2OH的合成路线流程图[无机试剂任用,合成路线流程图示例见本题]。________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com