
| A. | 40mL | B. | 72mL | C. | 128mL | D. | 20mL |
分析 根据电荷守恒计算出混合溶液中溶液中n(Al3+).由MgCl2和AlCl3的混合溶液与氢氧化钠溶液的反应可知,要使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,根据Na、Cl、Al原子守恒,有n(NaOH)=n(Cl)+n(Al),再根据V=$\frac{n}{c}$计算即可.
解答 解:溶液中n(Cl-)=0.1L×0.65mol/L=0.065mol,
溶液中n(Mg2+)=0.1mol/L×0.1L=0.01mol,
所以溶液中n(Al3+)=$\frac{0.065mol-0.01mol×2}{3}$=0.015mol,
将100mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,反应后溶液为NaCl、NaAlO2的混合液,
由原子守恒可知n(NaOH)=n(Na)=n(Cl)+n(Al)=0.065mol+0.015mol=0.08mol,
所以至少需要2mol/L氢氧化钠溶液的体积为:$\frac{0.08mol}{4mol/L}$=0.02L=20mL,
故选D.
点评 本题考查混合物的有关计算,题目难度中等,明确发生反应的实质为解答关键,注意利用原子守恒可简化解题过程,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 14% | B. | 16% | C. | 11% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
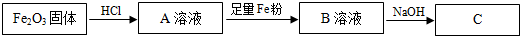
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
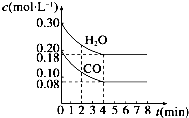 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H<0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30mol CO、0.10mol H2O、0.20mol CO2和20mol H2,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g金属铁与一定量的硝酸反应时失去的电子数一定为3NA | |
| B. | 2mol SO2和1mol O2在密闭容器中加热(V2O5催化) 充分反应后,容器内分子总数为2NA | |
| C. | 1mol Cu和足量稀硝酸反应产生NA个NO分子 | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 在1L 0.5 mol/L的盐酸加入1.5 mol/L盐酸1L | |
| D. | 从1000mL 1mol/LNaCl溶液中取出100mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯的结构简式: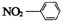 | B. | CO2分子比例模型: | ||
| C. | HClO的电子式: | D. | 中子数为10的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com