
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
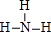 (填结构式);
(填结构式);分析 ①只有最低价-2价,则①为O;⑤有+7、-1价,处于ⅦA族,为Cl元素;④⑦有+5、-3价,处于ⅤA族,且④原子半径较大,则④为P、⑦为N;③⑥只有最高正价+1价,处于ⅠA族,且⑥的原子半径较大,③原子半径不是最小,则③为Li、⑥为Na;②最高价+2价,处于ⅡA族,原子半径大于P,则②为Mg,据此解答.
解答 解:①只有最低价-2价,则①为O;⑤有+7、-1价,处于ⅦA族,为Cl元素;④⑦有+5、-3价,处于ⅤA族,且④原子半径较大,则④为P、⑦为N;③⑥只有最高正价+1价,处于ⅠA族,且⑥的原子半径较大,③原子半径不是最小,则③为Li、⑥为Na;②最高价+2价,处于ⅡA族,原子半径大于P,则②为Mg.
(1)元素⑤为Cl元素,在周期表中的位置:第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)元素非金属性N>P,故NH3较稳定,结构式为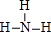 ,故答案为:
,故答案为: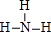 ;
;
(3)元素④为P元素,形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是PCl3,故答案为:PCl3;
(4)A.氨气分子之间存在氢键,沸点高于PH3,故A正确;
B.①与②形成的化合物为MgO,不具有两性,故B错误;
C.金属性Mg<Na,故Na与稀盐酸更快,故C错误;
D.金属性Li<Na,故NaOH的碱性强于LiOH,故D错误,
故选:A.
点评 本题考查性质结构位置关系应用,根据化合价与原子半径推断元素是解题的关键,注意掌握元素周期律,难度中等.


科目:高中化学 来源: 题型:解答题
 有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的电子外围电子构型为nsnnpn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38:77.据上可推知:
有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的电子外围电子构型为nsnnpn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38:77.据上可推知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,上述反应的平衡常数增大 | |
| B. | 其他条件不变,压缩容器,V正、V逆均增大 | |
| C. | 保持容器的容积不变,向密闭容器中充入CO2,平衡逆向移动 | |
| D. | 保持体系的压强不变,向密闭容器中充入氦气,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 中任意两种.
中任意两种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C7H10O5 | |
| B. | 分子中含有3种官能团 | |
| C. | 可发生加成反应和酯化反应 | |
| D. | 在水溶液中羧基和羟基均能电离出H+而使溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,N2完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应和逆反应速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为酸性溶液,正极为PbO2、负极为Pb | |
| B. | 电池放电时,正极反应为PbO2+2 e-+SO42-+4H+═PbSO4+2H2O | |
| C. | 电池充电过程中,阳极附近溶液的pH升高 | |
| D. | 电池充电时,阴极反应为PbSO4+2e-═Pb+SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com