
|
在Fe2O3与Fe的混合物中加入过量盐酸后,逸出的气体在标准状况下体积为2.24 L.测知反应后溶液的体积为2 L,其中c(Fe2+)=0.2 mol·L-1.向反应后的溶液中加入KSCN溶液,溶液不显红色,则混合物中Fe2O3与Fe的质量比为 | |
A. |
1∶2 |
B. |
4∶3 |
C. |
40∶21 |
D. |
10∶7 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.现用下图中甲、乙两套仪器装置制取上述铁的氧化物和细铁粉.制取上述铁的氧化物和细铁粉时必须使用普通铁粉和6mol?L-1盐酸,其他试剂任选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热装置等以及仪器中所装的试剂在图中均已略去).
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.现用下图中甲、乙两套仪器装置制取上述铁的氧化物和细铁粉.制取上述铁的氧化物和细铁粉时必须使用普通铁粉和6mol?L-1盐酸,其他试剂任选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热装置等以及仪器中所装的试剂在图中均已略去).
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:013
在Fe与Fe2O3混合物中, 加入过量的H2SO4, 充分反应后得到FeSO4溶液, 当生成的 FeSO4与H2的物质的量之比为4:1时, 则加入的Fe2O3与Fe的质量之比为
[ ]
A. 20:7 B. 10:7 C. 1:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源:2014届江苏省泰州市姜堰区高三上学期期中考试化学试卷(解析版) 题型:填空题
活性Fe3O4为黑色固体,有磁性,其不溶于水、碱和酒精、乙醚等有机溶剂中, Fe3O4在潮湿的空气中或高温下易被O2氧化。工业上利用锈蚀废铁为原料,利用共沉淀法制备活性Fe3O4(或写为FeO·Fe2O3)的流程如下:
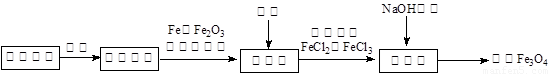
(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是 。
(2)设计合理的实验方案证明Fe3O4与盐酸反应的产物中含有Fe2+、Fe3+,简述实验操作步骤和实验现象 。
(可供选择的试剂:KSCN溶液、还原铁粉、氯水、酸性高锰酸钾溶液)
(3)假如在反应池中几乎没有气体产生,在合成池里所有铁元素转化为Fe3O4,则根据相关反应可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近于 。
(4)在一次制备Fe3O4的实验中,由于配料中心反应物比例控制不当,获得了另一种产品FexOy。取一定量该产品溶于足量盐酸中,还需通入标准状况下224 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液滴加足量NaOH溶液,将沉淀过滤、洗涤、蒸干,灼烧至恒重,得8 g固体。计算该产品的化学式。(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
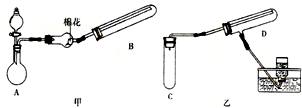 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.现用下图中甲、乙两套仪器装置制取上述铁的氧化物和细铁粉.制取上述铁的氧化物和细铁粉时必须使用普通铁粉和6mol?L-1盐酸,其他试剂任选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热装置等以及仪器中所装的试剂在图中均已略去).
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.现用下图中甲、乙两套仪器装置制取上述铁的氧化物和细铁粉.制取上述铁的氧化物和细铁粉时必须使用普通铁粉和6mol?L-1盐酸,其他试剂任选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热装置等以及仪器中所装的试剂在图中均已略去).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com