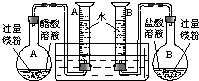
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
A、B两个量筒口用胶塞密封,反应产生的H2会造成压强过大而发生危险[或密封的量筒内气压随反应开始后不断增大,会造成烧瓶或量筒因压强过大将胶塞推出]
A、B两个量筒口用胶塞密封,反应产生的H2会造成压强过大而发生危险[或密封的量筒内气压随反应开始后不断增大,会造成烧瓶或量筒因压强过大将胶塞推出]
,其改进方法是
除去A、B量筒口的胶塞
除去A、B量筒口的胶塞
.
(2)改进装置后,检查一侧装置的气密性的方法是
将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气
将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气
.
(3)欲配制100mL实验所需浓度的盐酸,除50mL量筒、烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
100mL容量瓶、玻璃棒
100mL容量瓶、玻璃棒
.
正确操作,记录得到下表中部分实验数据.分析数据,观察实验装置图,回答下列问题:
| A烧瓶中 |
B烧瓶中 |
20℃、101kPa
50mL量筒内气体读数 |
反应时间 |
| A瓶 |
B瓶 |
40mL0.1mol/L
醋酸溶液 |
40mL0.1mol/L
盐酸溶液 |
5mL |
t(a1)=155s |
t(b1)=7s |
| 10mL |
t(a2)=310s |
t(b2)=16s |
| 15mL |
t(a3)=465s |
t(b3)=30s |
| 20mL |
t(a4)=565s |
t(b4)=64s |
| … |
… |
… |
| 44.8mL |
t(an)=865s |
t(bn)=464s |
(4)在实验数据中:①t(a
1)远远大于t(b
1)的原因为:
开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+]
开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+]
;
②由
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
[用含t(b
1)、t(b
2)、t(b
3)代数式表示]说明盐酸是可能不存在电离平衡;由
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
[用含t(a
1)、t(a
2)、t(a
3)代数式表示]说明醋酸中存在电离平衡.
(5)通过该实验可得到的结论是(回答出两点即可):①
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大,过一段时间后醋酸较盐酸反应速率的快
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大,过一段时间后醋酸较盐酸反应速率的快
;②
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
.

 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案