
【题目】下列说法正确的是
A.二氧化硅溶于水显酸性B.二氧化碳通入Na2SiO3溶液中可以得到硅酸
C.二氧化硅常用作干燥剂D.二氧化硅是酸性氧化物,它不溶于任何酸
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的储存及处理方法错误的是
A.常温时液氯用钢瓶储存B.未用完的钠、钾放回原试剂瓶
C.尾气中氯气用烧碱溶液吸收D.氧化性和还原性废弃物混合后直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A~R 10种元素在周期表中的位置(填元素符号):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | E | J | F | |||||
3 | A | C | D | G | R | |||
4 | B | H |
i. 请填空:
(1)这10种元素中,化学性质最不活泼的是____(填元素符号)。
(2)D元素最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是____。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为____(填元素符号)。
(4)EF2的电子式为____,F元素的最简单氢化物在常温下跟B发生反应的化学方程式是____。
(5)G元素和H元素两者核电荷数之差是____。
ii. 元素J的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
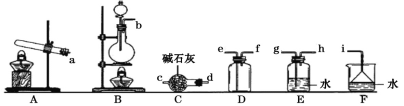
①只用固体药品制备氨气的发生装置可以选择上图中的____,反应的化学方程式为____。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)。
③将上述收集到的NH3充入无色透明烧瓶中,并加入少量催化剂,然后充入NO2。常温下反应一段时间后的实验现象为____,反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等.
Ⅰ.(1)以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g)。已知:
2C3H6(g)。已知:
①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H 1=-1411KJmol-1
②C3H6(g)+![]() O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
③C4H8(g)+6O2(g)═4CO2(g)+4H2O(l)△H 3=-2539KJmol-1
“烯烃歧化法”的反应的热化学方程式为_____________________。
(2)一定温度下,在一体积恒为 V 升的密闭容器中充入一定量的 C4H8 和 C2H4,发生烯烃歧化法的 主要反应。 t1 时刻达到平衡状态,此时容器中 n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=b mol, 且 C3H6 占平衡总体积的 1/4。
①求该时间段内的反应速率 v(C4H8)=_____________。 (用只含 a、V、t1 的式子表示)
②判断该反应达到平衡的标志是______________
A.2v (C4H8) 生成=v (C3H6) 消耗
B.C4H8、C2H4、C3H6 的物质的量之比为 1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6 的浓度均不再变化
(3)Kp 是用反应体系中气体物质的分压来表示的平衡常数,即将 K 表达式中平衡浓度用平衡分压代替。已知反应﹕C4H8(g)+C2H4(g)![]() 2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
Ⅱ.“丁烯裂解法”是另一种重要的丙烯生产法,但生产过程中会有生成乙烯的副反应发生.反应如下主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(P)变化的趋 势分别如图 1 和图 2 所示:
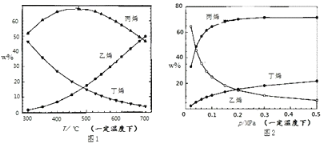
(1)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图 1 和图 2 中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号).
A.300oC 0.1MPa B.700oC 0.1MPa C.300oC 0.5MPa D.700oC 0.5MPa
(2)有研究者结合图 1 数据并综合考虑各种因素,认为 450℃的反应温度比 300℃或 700℃更合适, 从反应原理角度分析其理由可能是________________.
(3)图2中,随压强增大平衡体系中丙烯的百分含量呈上升趋势,从平衡角度解释其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的 L 层电子数为 ___________;
(2)肼(N2H4)又称联氨。无色油状液体。有类似于氨的刺鼻气味。可作为火箭发动机的燃料。
①)肼中氮元素的化合价为 ____。
②NH3 与 NaClO 反应可得到肼,该反应的化学方程式为_____。
③16g 液态肼在空气中燃烧,生成氮气和水蒸气时放出的热量为 267.1kJ,写出该反应的热化学方程式: ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g) ![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
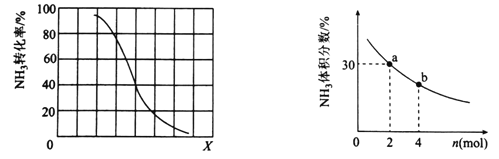
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
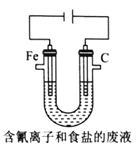
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)
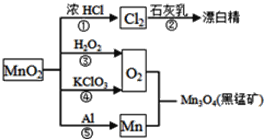
A. 反应⑤说明该条件下铝的还原性强于锰
B. 反应①②③④⑤均属于氧化反应和离子反应
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com