
【题目】甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。

①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
【答案】 413 0.28 0.5 增大压强 > > a c
【解析】试题分析:(1)根据盖斯定律:反应③+反应①=反应②,故△H=△H2-△H3=-58kJmol-1-(+41kJ.mol-1)=-99kJ.mol-1,反应热=反应物总键能-生成物总键能,故
△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×x+343+465)kJ.mol-1=-99kJ.mol-1,解得:x=413;
(2)①有图表可知,3min时H2的物质的量为3mol,则H2变化物质的量为5mol,CH3OH的变化物质的量为![]() ,0~3min内CH3OH的平均反应速率v=
,0~3min内CH3OH的平均反应速率v=![]() =0.28mol/(L·min);8min后反应达到平衡状态,此时H2的物质的量为2mol,变化物质的量为6mol,此时平衡状态中CO2的物质的量为4mol,CH3OH的物质的量为2mol,H2O(g)的物质的量为2mol,此时平衡常数K=
=0.28mol/(L·min);8min后反应达到平衡状态,此时H2的物质的量为2mol,变化物质的量为6mol,此时平衡状态中CO2的物质的量为4mol,CH3OH的物质的量为2mol,H2O(g)的物质的量为2mol,此时平衡常数K=![]() =0.5;
=0.5;
②状态Ⅱ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强;
③状态Ⅲ反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故状态Ⅲ对应的温度>T℃;
④状态Ⅱ与状态I相同温度下发生的反应;状态Ⅲ是升高温度,温度升高平衡逆向移动,平衡常数减小,则K2>K3;
(5)a.因气态反应物与气态生成物的系数和不等,则容器中压强不变时,是平衡状态,故a正确;b.随着反应的进行,甲醇和水蒸汽的体积比可能始终保持不变,则不一定是平衡状态,故b错误;c.当v正(H2)=3v逆CH3OH) 时,反应达到平衡状态,故b正确;d.C=O断裂和H—H断裂都说明反应正向进行,不能说明是平衡状态,故d错误;答案为ac。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】某同学为了探究原电池产生电流的过程,设计了如图所示实验。
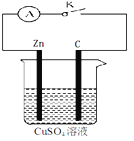
(1)打开K,观察到的现象为 ,
(2)关闭K,观察到的现象是 ,
此电池的负极的电极反应式为 ,
总反应式为 。
(3)关闭K,溶液中阳离子向 (填Zn或C)极运动,
外电路中,电子流动方向是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
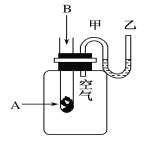
(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量 ________(填“高”或“低”)。
(3)物质中的化学能通过________转化成________释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟九号”载人飞船与天宫一号目标飞行器首次完美交会对接,标志着我国成功实现首次载人空间交会对接。“长征”系列火箭用偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出该反应的化学方程式:________________________________________
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量______(填“大于”、“小于”或“等于”)生成物的总能量,断开化学键________的总能量小于形成化学键________的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国环境监测数据显示,颗粒物(PM2.5等)为雾霾过程中影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气。
(1)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(2)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,得到两组数据
CO2(g)+H2(g) ΔH,得到两组数据
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
该反应的![]() H 0(填“<”或“>”);若在7500C时,另做一组实验,在2L的恒容密闭容器中加入lmol CO,3mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
H 0(填“<”或“>”);若在7500C时,另做一组实验,在2L的恒容密闭容器中加入lmol CO,3mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
(3)一定条件下,某密闭容器中已建立A(g)+B(g) ![]() C(g)+D(g)/span> △H>0的化学平衡,其时间速率图像如图,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是
C(g)+D(g)/span> △H>0的化学平衡,其时间速率图像如图,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是

A.减小压强,同时升高温度,平衡正向移动
B.增加A(g)浓度,同时降低温度,平衡不移动
C.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H1<0
2N2(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g) +2NO2(g)![]() N2(g) +CO2(g) +2H2O(g) △H2<0
N2(g) +CO2(g) +2H2O(g) △H2<0
(4)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO)︰V (NO2)= 。
(5)在不同条件下,NO的分解产物不同。在高压下,NO(即X)在40℃下分解生成两种化合物(即Y、Z),体系中各组分物质的量随时间变化曲线如图所示。写出Y和Z的化学式:

(6) 某研究性学习小组,为研究光化学烟雾消长规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于右图,根据图中数据,下列推论,最不合理的是

A.NO的消失的速率比RH快
B.NO生成NO2
C.RH及NO2可以生成PAN及O3
D.O3生成PAN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。请回答下列问题:
,它可通过不同化学反应分别制得B、C、D和E四种物质。请回答下列问题:
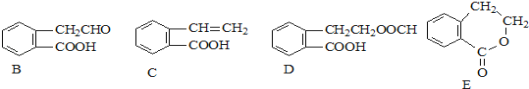
(1)在A~E五种物质中,互为同分异构体的是 (填代号)。
(2)写出由A生成D的化学方程式 。由A生成E的反应类型为 。
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(4)C能形成高聚物,该高聚物的结构简式为 。
(5)写出一种区分D和E的试剂 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):

(1)Ⅰ的分子式为_____________;
(2)反应①的反应类型是_____________,反应④的反应类型是_____________。
(3)写出反应②的化学反应方程式____________ _________。
(4)香豆素在过量NaOH溶液中完全水解的化学方程式为_____________________。
(5)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为_______________(任写两种)。
(6)一定条件下,![]() 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为690pm和780pm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一有机物A可发生下列反应:
![]()
已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com