
2.3g某有机物A完全燃烧后,生成0.1 mol CO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式。
(1)求2.3g该有机物中组成元素的质量:
C: C → CO2
12 44
m(C) 44g/mol×0.1mol
![]()
=1.2g
H: 2H → H2O
2 18
m(H) 2.7g
![]()
=0.3g
m(C)+m(H)=1.2g+0.3g=1.5g<2.3g
该有机物中C的质量与H的质量之和(1.5g)小于该有机物的质量
(2.3g),因此该有机物A中还含有O,其质量为:
m(O)=m(A)-m(C)-m(H)
=2.3g-1.5g
=0.8g
(2)求该有机物的相对分子质量:
Mr(A)=d×Mr(空气)
=1.6×29
=46
(3)求该有机物分子中各元素原子的数目:
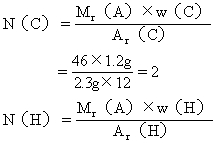

答:该有机物的分子式是C2H6O。
根据实验,该有机物燃烧的产物只有CO2和H2O,因此,该有机物中一定含有C和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身。因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断。该有机物的相对分子质量,则可以利用实验测出的相对密度来求。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2009-2010学年广东省梅州中学高一(下)月考化学试卷(6月份)(解析版) 题型:解答题
查看答案和解析>>
科目:高中化学 来源:0119 月考题 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com