
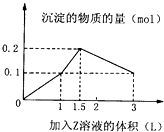
 某1L混合溶液中,溶质X、Y的浓度都为0.1mol?L-1,向混合溶液中滴加某溶液Z(0.1molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
某1L混合溶液中,溶质X、Y的浓度都为0.1mol?L-1,向混合溶液中滴加某溶液Z(0.1molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )| A、硫酸铝、硫酸铁、氢氧化钠 |
| B、硫酸铝、硫酸镁、氢氧化钠 |
| C、偏铝酸钠、氢氧化钡、硫酸 |
| D、偏铝酸钠、氯化钡、硫酸 |


科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取少量该溶液,加AgNO3 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| (5)取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
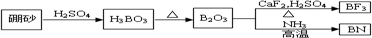
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室制取乙烯的反应原理为:CH3CH2OH
实验室制取乙烯的反应原理为:CH3CH2OH| 浓硫酸 |
| 170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeI2溶液中通入足量氯气,当有1mol Fe2+被氧化时,总共转移电子的数目3NA | ||
| B、1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 | ||
| C、在反应KIO3+6HI=3I2+KI+3H2O中,每生成1mol I2转移电子数为2NA | ||
D、CO2通过足量Na2O2使固体增重bg时,反应中转移的电子数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A、根据表中数据不能计算出混合物中NaHCO3的质量分数 |
| B、加入混合物9.2g时盐酸过量 |
| C、15.7g混合物未与盐酸完全反应 |
| D、盐酸的物质的量浓度为3.0mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com