
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
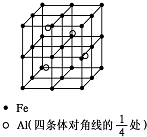 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
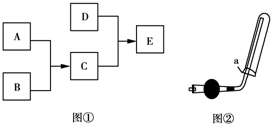 已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可使酚酞变红,它们之间的转化关系如图①所示:
已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可使酚酞变红,它们之间的转化关系如图①所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,且E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,且E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制盐酸溶液用量筒量取盐酸时俯视刻度线 |
| B、浓H2SO4稀释后未经冷却即注入容量瓶配制 |
| C、配制100mL1mol/L Na2CO3溶液时,砝码放在托盘天平左盘 |
| D、配制盐酸溶液定容时,仰视容量瓶刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com