
| A. | 酸性强弱:HClO3>H2SO3>H3PO4 | B. | 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性HCl>H2S>PH3 | D. | 氧化性Na+>Mg2+>Al3+ |
分析 A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C.元素的非金属性越强,对应的氢化物的稳定性越强;
D.金属单质的还原性越强,对应的离子的氧化性越弱.
解答 解:A.非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,应为HClO4>H2SO4>H3PO4,否则不能比较酸性强弱,故A错误;
B.金属性K>Ca>Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,因Ca(OH)2溶解度较小,则碱性KOH>NaOH>Ca(OH)2>Mg(OH)2,故B错误;
C.非金属性Cl>S>P,元素的非金属性越强,对应的氢化物的稳定性越强,故C正确;
D.金属单质的还原性Na>Mg>Al,氧化性Na+<Mg2+<Al3+,故D错误.
故选C.
点评 本题考查元素周期律知识,为高考高频考点,侧重于学生的分析能力的考查,注意把握元素的性质与对应单质、化合物的性质的关系以及比较角度,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加入适量盐酸 | B. | 加入NaOH溶液 | ||
| C. | 置于坩埚中加热 | D. | 配成溶液后通入CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
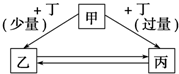 甲、乙、丙、丁均为中学化学中常见的物质,它们之间存在如图所示的转化关系(部分产物略去),甲不可能是( )
甲、乙、丙、丁均为中学化学中常见的物质,它们之间存在如图所示的转化关系(部分产物略去),甲不可能是( )| A. | NaOH溶液 | B. | Fe | C. | Al2O3 | D. | C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(S2-)>r(O2-)>r(F-) | B. | r(Al)>r(Mg)>r(Na) | C. | r(Na+)>r(O2-)>r(F-) | D. | r(Na)>r(Na+)>r(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
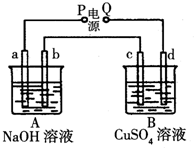 按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.
按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属晶体能导电,所以离子晶体也能导电 | |
| B. | 六方最密堆积和面心立方最密堆积中由于配位数都是12,所以所得晶胞的形式相同 | |
| C. | 金属晶体中金属原子的堆积模式有4种 | |
| D. | 金属晶体的电子气理论不能解释金属的延展性,但可以解释金属的导电性和熔点高低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com