


| H2C204 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
| HF | Ka=6.32×10-4 | |
分析 制备BaCl2•2H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,蒸发浓缩冷却结晶得到BaCl2•2H2O,
(1)“浸取”环节发生的主要反应为溶解生成二氧化碳、氯化钡和水,是碳酸钡和盐酸反应实验室用37%的盐酸配置15%的盐酸,需量取浓盐酸的体积和水的体积,且需使用烧杯作为容器稀释,玻璃棒搅拌;
(2)加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,草酸和钡离子会形成草酸钡沉淀;
(3)①HC2O4-溶液中存在电离平衡,结合平衡常数书写电离平衡常数;
②草酸电离平衡常数大于HF电离平衡常数,草酸和氟化钠反应生成HF,H2C2O4溶液和NaF溶液反应生成HF;
解答 解:(1)“浸取”环节发生的主要反应为溶解生成二氧化碳、氯化钡和水,反应的离子方程式为:BaCO3+2H+═Ba2++CO2↑+H2O,实验室用37%的盐酸配置15%的盐酸,需计算出浓盐酸的体积和水的体积,需用量筒量取,浓盐酸稀释为稀盐酸,需用烧杯作为容器稀释选择a,玻璃棒搅拌加速溶解选择d,
故答案为:BaCO3+2H+═Ba2++CO2↑+H2O,ad;
(2)①加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀
故答案为:Fe(OH)3,Mg2+、Ca2+;
②溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少,
故答案为:H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少;
(3)①HC2O4-的电离平衡为:HC2O4-的?H++C2O42-,电离平衡常数表达式K=$\frac{c(H+)?c(C2O42-)}{c(HC2O4-)}$,
故答案为:$\frac{c(H+)?c(C2O42-)}{c(HC2O4-)}$;
②草酸电离平衡常数大于HF电离平衡常数,草酸酸性大于氢氟酸,草酸和氟化钠反应生成HF,反应的离子方程式为:H2C2O4+F-═HF+HC2O4-,
故答案为:H2C2O4+F-═HF+HC2O4-;
点评 本题考查了物质分离提纯和实验基本操作,离子性质、电离平衡常数、弱酸制备等知识点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
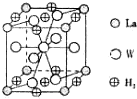 有A、B、C、D、E、F、G、W八种原子序数依次增大的元素(原子序数均小于30),A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,E、F同主族,G与W同周期同族且原子序数相差2.请回答下列问题:
有A、B、C、D、E、F、G、W八种原子序数依次增大的元素(原子序数均小于30),A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,E、F同主族,G与W同周期同族且原子序数相差2.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4;途径b:Cu$\stackrel{浓H_{2}SO_{4}}{→}$CuSO4 | |
| C. | 用金属钠可区分乙醇和乙醚 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| B. | 袋装食品常用生石灰作为食品的抗氧化剂 | |
| C. | 金属焊接时可用饱和NH4Cl溶液作除锈剂 | |
| D. | 泡沫灭火器的内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90% | B. | 80% | C. | 70% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
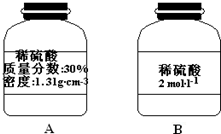
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 序 号 | 时间(min) 浓度(mol•L-1) 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 该反应是吸热反应,升温正、逆反应速率增大 | |
| B. | 实验3中 c3=1.2 mol•L-1 | |
| C. | 实验1与实验3比较,A的平衡转化率之比为1:2 | |
| D. | 实验2使用了催化剂,在0至10 min内平均速率υ(B)=0.02 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )
1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )| A. | 它的分子式是C6N10H2O2 | |
| B. | 该物质最多可以有18个原子处于同一个平面上 | |
| C. | 它可以与别的物质发生加成反应 | |
| D. | 因其含氮量高,有可能作炸药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com