
已知:HCN(aq)+NaOH(aq)═NaCN(aq)+H2O(l)△H=﹣12.1kJ•mol﹣1;
HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=﹣55.6kJ•mol﹣1
则HCN在水溶液中电离的△H等于( )
|
| A. | +43.5 kJ•mol﹣1 | B. | +67.7 kJ•mol﹣1 |
|
| C. | ﹣43.5 kJ•mol﹣1 | D. | ﹣67.7 kJ•mol﹣1 |
| 反应热和焓变. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | 利用盖斯定律进行计算,将已知两个热化学方程式相减得到HCN在水溶液中电离的电离方程式,同时反应热也随之相减,可得HCN在水溶液中电离的反应热. |
| 解答: | 解:反应的热化学方程式分别为: HCN(aq)+OH﹣(aq)═CN﹣(aq)+H2O(l)△H=﹣12.1kJ•mol﹣1…① H+(aq)+OH﹣(aq)═H2O(l)△H=﹣55.6kJ•mol﹣1…② HCN电离方程式为,HCN 用①﹣②可得HCN电离的热化学方程式为HCN(aq) 故选A. |
| 点评: | 本题考查反应热的计算,本题难度不大,做题时注意盖斯定律的应用方法. |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
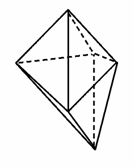
碘元素有多种价态,可能形成多种含氧阴离子IxO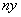 。由2个IO
。由2个IO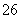 正八面体共用一个面形成的IxO
正八面体共用一个面形成的IxO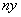 的化学式为( )
的化学式为( )
A.I2O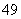 B.I2O
B.I2O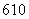
C.I2O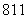 D.I2O
D.I2O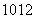
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨的反应为N2(g)+3H2(g)⇌2NH3(g).设t℃在容积为2L的密闭容器中充入0.6mol N2和1.6mol H2,反应在一定条件下达到平衡时,NH3的物质的量分数为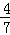 .计算:
.计算:
(1)达到平衡时H2的物质的量;
(2)t℃该反应的平衡常数.
查看答案和解析>>
科目:高中化学 来源: 题型:
反应 H2(g)+I2(g)⇌2HI(g)的平衡常数K1;反应HI(g)⇌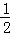 H2(g)+
H2(g)+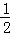 I2(g)的平衡常数K2,则K1、K2的关系为(平衡常数为同温度下的测定值)( )
I2(g)的平衡常数K2,则K1、K2的关系为(平衡常数为同温度下的测定值)( )
|
| A. | K1=2K2 | B. | K1=K22 | C. | K1= | D. | K1= |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定体积的密闭容器中,可逆反应,nA(g)+mB (g)⇌pC(g)已经达到平衡状态.已知n+m>p,正反应为放热反应.下列分析结论中正确的是( )
①升温,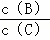 的值变小;
的值变小;
②降温,平衡体系内混合气体的平均相对分子质量变小;
③增加B的物质的量,A的转化率增大;
④使用催化剂,气体总的物质的量不变;
⑤加压使密闭容器的容积变小,A或B的浓度则变大;
⑥若A的反应速率为v(A),则v(B)=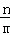 [v(A)].
[v(A)].
|
| A. | ①② | B. | ②③④ | C. | ③④⑤ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
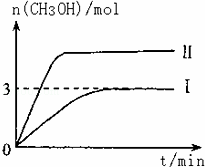
T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示.下列说法正确的是
( )
|
| A. | 曲线II对应的条件改变是减小压强 |
|
| B. | 若T2°C时上述反应的平衡常数为0.42,则T2<T1 |
|
| C. | 在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
|
| D. | 在T10C,若起始时向容器中通入4.5molCO2、6mol H2,平衡时容器内的压强P1=P/2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.二氧化硫溶于水能导电,故二氧化硫属于电解质
B.硫酸钡难溶于水,故硫酸钡属于弱电解质
C.硫酸是强电解质,故纯硫酸能导电
D.氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
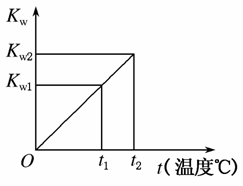
水的离子积常数Kw与温度t(℃)的关系如图所示:
(1)若t1=25 ℃,则Kw1=________;若t2=100 ℃时,Kw2=10-12,则此时0.05mol·L-1的Ba(OH)2溶液的pH=________。
(2)已知25 ℃时,0.1 L 0.1mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的平衡有:_______________________。
溶液中各离子的物质的量浓度由大到小的顺序为:________。
(3)25 ℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下6种物质中选取序号填空(仅填序号,可重复选填)。
①二氧化碳 ②硫化氢 ③氯化铵 ④氢氧化钾 ⑤甲醛 ⑥乙醇
(1)含有非极性键的是________;
(2)含有配位键的是________;
(3)既含有σ键又含有π键的是________;
(4)分子的立体结构呈平面三角形的是________;
(5)属于非极性分子的是________;
(6)属于离子化合物的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com