
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
分析 A.化学平衡常数指,一定温度下可逆达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意纯液态、固体不需要写出;
B.C为固体,加入少量生成物C,不影响反应速率;
C.该反应前后气体体积不变,增大该体系的压强,平衡不移动;
D.5min后反应达到平衡,测得生成C为0.8mol,结合方程式计算参加反应B的物质的量,进而计算B的转化率.
解答 解:A.可逆反应A(g)+B(g)?2C(s)+2D(g),由于C为固体,故该反应平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$,故A错误;
B.C为固体,加入少量生成物C,不影响反应速率,正、逆反应速率不变,故B错误;
C.该反应前后气体体积不变,增大该体系的压强,平衡不移动,A的转化率不变,故C错误;
D.5min后反应达到平衡,测得生成C为0.8mol,由A(g)+B(g)?2C(s)+2D(g),可知参加反应B的物质的量为0.8mol×$\frac{1}{2}$=0.4mol,故B的转化率为$\frac{0.4mol}{1mol}$×100%=40%,故D正确,
故选D.
点评 本题考查化学平衡计算、化学平衡常数、化学平衡影响因素、化学反应速率影响因素,难度不大,注意理解压强对反应速率与化学平衡的影响.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:解答题
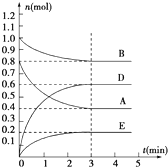 在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:
在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
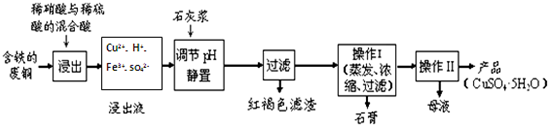
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
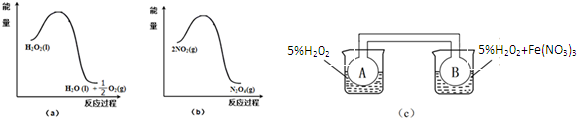
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验装置 | 现象 |
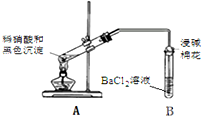 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
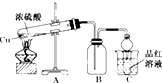 某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验.
某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的质量分数降低 | B. | 平衡向右移动 | C. | B的转化率升高 | D. | x+y<z |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第四周期IVA族 | B. | 第五周期IVA族 | C. | 第四周期VA族 | D. | 第五周期VA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.
有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com