
【题目】下列叙述正确的是( )
A. 硝酸具有氧化性 B. 光导纤维的主要成分是硅酸盐
C. 次氯酸是一种强酸 D. 钠的焰色为浅紫色
科目:高中化学 来源: 题型:
【题目】工业上常用二氧化硫来漂白纸浆、丝毛、草帽等,此外二氧化硫还能够抑制霉菌和细菌的滋生,可以用作食物和干果的防腐剂。但必须严格按照国家有关范围和标准使用,我国规定葡萄酒中SO2的最大使用量为0.25g/L。某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如下图,夹持仪器省略。
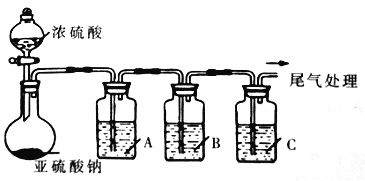
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等。
①请完成下列表格
试剂 | 作用 | |
A | _______ | 验证SO2的还原性 |
B | Na2S溶液 | ___ |
C | 品红溶液 | ___ |
②A中发生反应的离子方程式为_______________________。
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去。该方案是否合理________。(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为____________。
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性。该方案的不妥之处可能为_____________。
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量。取50.00ml葡萄酒样品于250ml碘量瓶中。加入少量碎冰块,再加入1ml淀粉指示液,10ml硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为Vml。以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml。该葡萄酒中SO2含量计算式为___g/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol L-1 | 0.10 | 0.20 | 0.20 |
C(SO2)/ mol L-1 | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol L-1 min-1
B. 达到平衡时,容器丙中正反应速率与容器甲相等
C. 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0
D. 容器乙中若起始时改充0.10 molL-1 NO2和0.20molL-1 SO2,达到平衡时c(NO)与原平衡相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合-铁(III)酸钾K3 [Fe(C2O4)3]·3H2O (Mr=491)为绿色晶体,易溶于水,难溶于乙醇等有机溶剂。110℃下可失去结晶水,230℃时即分解,是制备负载型活性铁催化剂的主要原料。以硫酸亚铁铵为原料制备三草酸合铁(III)酸钾晶体的流程如下所示:

请回答下列问题:
(1)实验室中也可用Fe3+盐代替硫酸亚铁铵来制备该晶体,需先用碱液沉淀Fe3+,若用同浓度的NaOH溶液或氨水通过相同操作来沉淀,选择______能获得颗粒较大的Fe(OH)3。
(2)氧化过程中采用水浴加热,控制最佳温度为40℃,理由是_______,发生反应的化学方程式为_______。氧化完全后需将所得溶液煮沸,目的是__________________。
(3)关于过程X的下列说法中不正确的是________________。
A.可采用冷却和向溶液中加入乙醇的方法促使晶体析出
B.为了快速得到较干燥的固体,可以采用抽滤的方法
C.洗涤晶体时,可先用少量水洗,再用乙醇洗
D.可用加热烘干的方法得到较干燥的晶体
(4)为了分析产品纯度,进行如下操作:
准确称取产品0.9350g,配制成250mL溶液。每次移取25.00mL置于锥形瓶中,加入足量稀H2SO4酸化,将C2O42-转化为H2C2O4,用0.0100mol/LKMnO4溶液滴定至终点,现象是_______。平行测定三次,消耗KMnO4的体积分别为20.02mL,19.98mL,20.00mL,则所得粗产品的纯度为_________________。(已知:5 H2C2O4+2 MnO4-+6H+=10CO2↑+2Mn2++8H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。

图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0-t1,t1-t3,t3-t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是____________。
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“ 向右”或“不”);使用催化剂反应的ΔH (填“增大”、“减小”或“不改变”)。
(3)温度为T ℃时,将2a mol H2和 a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.40 |
下列有关叙述正确的是
A. 1000℃时,反应 1/2CO(g)+1/2H2O(g)![]() 1/2CO2(g)+1/2H2(g)的平衡常数为0.3
1/2CO2(g)+1/2H2(g)的平衡常数为0.3
B. 上述反应的正反应是吸热反应
C. 若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.5mol时,该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() =
=![]() ,则此时的温度为1200℃
,则此时的温度为1200℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变能使反应速率加快的是
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变能使反应速率加快的是
①增加铁的量
②将容器的体积缩小一半
③保持体积不变,充入N2 使体系压强增大
④保持体积不变,充入水蒸汽使体系压强增大
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是( )

A. ①和②中发生的反应均为复分解反应
B. 向Na2SiO3饱和溶液中滴酚酞溶液变红
C. 一段时间后②中有胶冻状物质生成
D. 该实验能证明酸性强弱的顺序是:盐酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述是可逆反应A(g)+2B(g)![]() 2C(g)在定容密闭容器中达到平衡的标志的是:
2C(g)在定容密闭容器中达到平衡的标志的是:
①C的生成速率与C的分解速率相等;
②单位时间内消耗amol A,同时生成2amolC;
③A、B、C的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦A、B、C的分子数目比为1:3:2;
⑧混合气体的密度不再变化
A.②⑤ B.①③④⑤ C.②⑥⑦⑧ D.⑤⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com