
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
【答案】(1)第三周期第ⅣA族;
(2)![]() ;O=C=O;
;O=C=O;
(3)Cl->O2->Na+;HClO4>H2CO3>H2SiO3;
(4)H2O;水分子之间有氢键且是极性分子,相对分子质量比甲烷大;
(5)2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+。
【解析】试题分析:A、B、C、D、E均是短周期元素,其原子序数依次增大,A原子最外层电子数是内层电子数的二倍,则A为碳元素,A和D同族,则D为硅元素,A和B同周期,B元素族序数是周期数的三倍,则B为氧元素,B的阴离子与C的阳离子电子层结构相同,C的单质与 B 的单质在不同条件下反应,可生成C2B或C2B2,则C为钠元素,E是所在周期中原子半径最小的元素,则E为氯元素。
(1)D为硅元素,在元素周期表中第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(2)C2B为氧化钠,它的电子式是![]() ;AB2为二氧化碳,它的结构式是 O=C=O,故答案为:
;AB2为二氧化碳,它的结构式是 O=C=O,故答案为:![]() ;O=C=O;
;O=C=O;
(3)电子层数越多,离子半径越大,电子层数相同时,核电荷数越多,离子半径越小,所以B、C、E离子半径的由大到小的顺序为Cl->O2->Na+,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性就越强,非金属性Cl>C>Si,所以酸性HClO4>H2CO3>H2SiO3,故答案为:Cl->O2->Na+;HClO4>H2CO3>H2SiO3;
(4)由于水分子之间有氢键且是极性分子,相对分子质量比甲烷大,所以水的沸点高于甲烷,故答案为:H2O;水分子之间有氢键且是极性分子,相对分子质量比甲烷大;
(5)用ClO2可氧化Mn2+,生成黑色沉淀MnO2,当消耗13.50g (即0.2mol)ClO2时,共转移了1mol电子,根据电子得失守恒可写出反应的离子方程式为2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,故答案为:2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+。


科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料﹣纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4
+NH4HSO4
(苯乙腈)
![]() +Cu(OH)2→(
+Cu(OH)2→(![]() )2Cu+H2O
)2Cu+H2O
制备苯乙酸的装置示意图如图(加热和夹持装置等略):
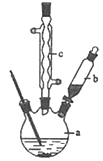
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇.
回答下列问题:
(1)在250mL三口瓶a中加入70mL 70%硫酸.配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 .
(2)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应.在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 .反应结束后加适量冷水,再分离出苯乙酸粗品.加入冷水的目的是 ,下列仪器中可用于分离苯乙酸粗品的是 (填标号)
A、分液漏斗
B、漏斗
C、烧杯
D、直形冷凝管
E、玻璃棒
(3)提纯苯乙酸的方法是重结晶,最终得到44g纯品,则苯乙酸的产率是 .(百分数)
(4)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
沉淀物 | Fe3+ | Al3+ | Mg2+ |
PH | 3.2 | 5.2 | 12.4 |
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(2)滤渣I的主要成分有 。
(3)从滤液Ⅱ中可回收利用的主要物质有 。
(4)若将MgCl2溶液加热蒸干得到的固体是__________,若要得到MgCl2应采取的操作是___________。
(5)用稀硫酸酸浸时形成滤渣的离子方程式有_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________,
H2SO4溶解Al2O3的离子方程式为:_____________________。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为: 。
(3)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:________________________,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________。
(4)已知:一定条件下,MnO![]() 可与Mn2+反应生成MnO2。
可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是: 。
②步骤Ⅳ中加入MnSO4的目的是: 。
(5)步骤Ⅴ中“一系列操作”是__________________、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行的关于铁的性质的下列实验:
步骤 

现象依次为ⅠFe表面产生大量无色气泡,液面上方变为红棕色
ⅡFe表面产生少量红棕色气泡后,迅速停止
ⅢFe、Cu接触后,其表面均产生红棕色气泡
下列说法中不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.P2O5不可用作食品干燥剂
C.六水合氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是改良西门子法生产多晶硅的工艺流程。

(1)用惰性电极电解饱和食盐水,写出常温下X与Z反应的化学方程式 。
(2)在合成SiHCl3的过程中,还会有生成副产物SiCl4。已知两物质的沸点分别为57.6℃和31.8℃,则提纯SiHCl3的方法是 。
(3)SiHCl3提纯后用H2还原:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)。不同温度及不同
Si(s)+3HCl(g)。不同温度及不同![]() 时,反应物X的平衡转化率关系如图图20-1所示。
时,反应物X的平衡转化率关系如图图20-1所示。
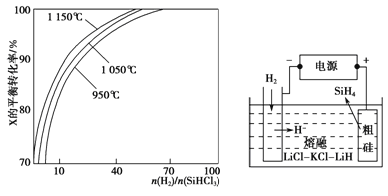
X是 (填“H2”或“SiHCl3”)。
②上述反应的平衡常数K(1150℃) K(950℃)(填“>”、“<”或“=”)。
(4)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。用粗硅作原料,熔融盐电解法制取硅烷原理如图20-2所示,电解时阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机化合物性质的叙述错误的是( )
A. 乙烯和苯都能使溴水褪色,均与溴水发生加成反应
B. 淀粉、油脂、蛋白质都能水解,但水解产物不同
C. 二氯甲烷只有一种说明甲烷分子是以碳原子为中心的正四面体结构
D. 乙醇、乙酸、乙酸乙酯都能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com