
����Ŀ����ͭ��������������к���Cu��Au(��)��PbSO4�����ʣ�ʪ����������������ۺ����õĹ���������ͼ��ʾ��

��1����⾫����ͭ����Ǧ�Ĵ�ͭʱ�����ҺӦ����________��Һ�����Һ�����ʱ�����ĵ缫��ӦʽΪ___________________________��Cu��2e��===Cu2����
��2����ɲ���������Ҫ�����У�__________________�����ˣ�ϴ�ӣ����
��3��д����SO2��ԭAuCl4-�����ӷ�Ӧ����ʽ____________________________��
��4��Ϊ�˼��ٷ�Һ�ŷš��������������Դ����ҵ�Ͻ���Һ1��������ͭ��Һ����ѭ����������ָ������ͼ����һ�����Ƶ�����________________________��
��5�������ӷ���ʽ��ʾ����̼������Һ�����ã�___________________________��[��֪298 Kʱ��Ksp(PbCO3)��1.46��10��13��Ksp(PbSO4)��1.82��10��8]������Һ��c(SO42-)=0.2mol/Lʱ��c(CO32-)=_______________mol/L�����������2λ��Ч���֣�
���𰸡�CuSO4 Pb-2e-+SO42-=PbSO4 ����Ũ������ȴ�ᾧ 3SO2+2AuCl4-+6H2O=2Au+3 SO42-+8Cl-+12H+ ����Һ2�ܽ������������������ܽ������� PbSO4��s��+CO32-(aq)![]() PbCO3��s��+SO42-(aq) 1.6��10-6
PbCO3��s��+SO42-(aq) 1.6��10-6
��������
��ͭ��������������к���Cu��Au(��)��PbSO4�����ʣ����պ����ͭ��Ϊ����ͭ��������Եõ�����ͭ��Һ������ͭ��Һ��������Ũ�������½ᾧ�����ˡ�ϴ��������������ͭ������Au(��)��PbSO4�����ʾ�̼���ƽ�ϴ��Ũ���������������˵õ�����Ǧ��Һ����Һ��������������Ǧ�������ٹ��˵õ�����Ǧ����Ǧ������Ҫ�ǽ�������ˮ�ܽ����õ�����AuCl4-����Һ��AuCl4-���Ա�SO2��ԭ�õ�Au���Դ˽��
��ͭ��������������к���Cu��Au(��)��PbSO4�����ʣ����պ����ͭ��Ϊ����ͭ��������Եõ�����ͭ��Һ������ͭ��Һ��������Ũ�������½ᾧ�����ˡ�ϴ��������������ͭ������Au(��)��PbSO4�����ʾ�̼���ƽ�ϴ��Ũ���������������˵õ�����Ǧ��Һ����Һ��������������Ǧ�������ٹ��˵õ�����Ǧ����Ǧ������Ҫ�ǽ�������ˮ�ܽ����õ�����AuCl4-����Һ��AuCl4-���Ա�SO2��ԭ�õ�Au��
(1)��⾫����ͭʱһ��������ͭ��Һ���������Һ����⾫���Ĵ�ͭ�������ᷢ��������Ӧ�����е���ͭ�ͻ����Ա�Cuǿ�Ľ������ᷢ���ܽ�����˴�ͭ�е�ͭ��Ǧ�ᷢ��ʧ���ӵ�������Ӧ���缫��ӦʽΪ��Pb-2e-+SO42-=PbSO4��
��ˣ�������ȷ������CuSO4��Pb-2e-+SO42-=PbSO4��
(2) ����I�IJ����Ǵ�����ͭ��Һ�л������ͭ��������˸ò���������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ�����
��ˣ�������ȷ����������Ũ�������½ᾧ��
(3) SO2��ԭAuCl4-�л�ԭ�������������Ƚ���ȷ����˺������Ʋ������������SO42-����ԭ������Au������������ԭ��Ӧ��ʧ�����غ���ȱ����ƽ��Ȼ����ݵ���غ�����ƽ����˵õ��ķ�Ӧ����ʽΪ��3SO2+2AuCl4-+6H2O=2Au+3 SO42-+8Cl-+12H+��
��ˣ�������ȷ������3SO2+2AuCl4-+6H2O=2Au+3 SO42-+8Cl-+12H+��
(4) ��Һ1���ڽᾧ����ͭʱʣ�µ���Һ��������������δ����������ͭ����˲���ǰ�������ͭ��Һ����ѭ���������ڳ��������������ƴ˴���������Ӧ���������еõ�����һ��Һ2������Һ2��������Ǧ��Һ�м���������������Ǧ����������������Ǧ��ʣ�µ���Һ������Һ��H+û�з�����Ӧ����˻��д�����������Һ�����Կ��Ѵ���Һ�����������ǰ��ļ�������ܽ�������
��ˣ�������ȷ���ǣ�����Һ2�ܽ������������������ܽ���������
(5) ͨ���Ƚ����ֳ������ܶȻ������Կ���̼��Ǧ������Ǧ�������������������Ǧ�м���̼�������������dz����ܽ�ת���ķ�Ӧ�����ӷ���ʽҪע�����״̬������ʽΪ��PbSO4��s��+CO32-(aq)![]() PbCO3��s��+SO42-(aq)��
PbCO3��s��+SO42-(aq)��
����Һ��c(SO42-)=0.2mol/Lʱ��c(CO32-)=![]() ��c(SO42-)=
��c(SO42-)=![]() ��0.2mol/L=1.6��10-6mol/L��
��0.2mol/L=1.6��10-6mol/L��
��ˣ�������ȷ������PbSO4��s��+CO32-(aq)![]() PbCO3��s��+SO42-(aq)��1.6��10-6��
PbCO3��s��+SO42-(aq)��1.6��10-6��


 �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��CH3COOH�ĵ���ƽ�ⳣ��ΪK����20mL 0.1mol/L CH3COOH��Һ����μ���0.1mol/L NaOH��Һ����pH�仯������ͼ��ʾ�������¶ȱ仯��������˵������ȷ���ǣ� ��

A. b���ʾ����Һ��c(Na+)��c(CH3COO��)
B. c���ʾCH3COOH��NaOHǡ�÷�Ӧ��ȫ
C. d���ʾ����Һ��c(CH3COO��) c(H+)/c(CH3COOH)����K
D. b��c��d�����ʾ����Һ��һ�������ڣ�c(Na+)+c(H+)�Tc(CH3COO��)+c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ����������������Ϊ36.5%���ܶ�Ϊ1.20 g��mL��1��
��1����Ũ������HCl�����ʵ���Ũ����________��
��2������100 mL��Ũ���ᣬ��Ҫ��״����HCl�����Ϊ________��
��3������100 mL 3.00 mol��L��1�����ᣬ������Ũ��������Ϊ________��
��4����10.0 mL 3.00 mol��L��1��������10.0 mL 1.00 mol��L��1��MgCl2��Һ��ϣ�������Һ��Cl�������ʵ���Ũ����________��(���Ϻ���Һ���������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���ڷ�������ԭ��Ӧ���ǣ�������
A. Fe2O3��3CO![]() 2Fe��3CO2
2Fe��3CO2
B. NH4NO3![]() N2O��ʮ2H2O
N2O��ʮ2H2O
C. 2FeCl2+Cl2=2FeCl3
D. Cu2��OH��2CO3![]() 2CuO��CO2����H2O
2CuO��CO2����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���ﺬ�е�NO������������ȼ��ȼ�յĸ�����������������Ӧ��N2(g)��O2(g��![]() 2NO(g����H ��0����֪�÷�Ӧ��240����ƽ�ⳣ��K��64��10��4����ش�
2NO(g����H ��0����֪�÷�Ӧ��240����ƽ�ⳣ��K��64��10��4����ش�
��1��ij�¶��£���2 L���ܱ������г���N2��O2��1 mol��5���Ӻ�O2�����ʵ���Ϊ0.5 mol����N2�ķ�Ӧ����Ϊ_____________________��
��2���ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־________ ��
A������1 mol N2ͬʱ����1 mol O2
B����������ܶȲ���
C���������ƽ����Է�����������
D��2v��(N2)��v��(NO)
��3����N2��O2�Ļ�����������º����ܱ������У���ͼ�仯������ȷ����____________(����ĸ���)��
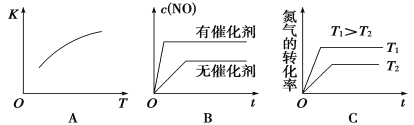
��4������º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ��������NO���������________��(��������С�����䡱)
��5�����¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10��1 mol��L��1��4.0��10��2 mol��L��1��3.0��10��3 mol��L��1����ʱ��Ӧ___________________(����ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С�)��������________________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������˵���в���ȷ����
A. ��״����22.4 L�춡��ķ�����ΪNA
B. 78 g��(C6H6)�ͱ���ϩ(C8H8)�Ļ�����к��е�̼�����һ��Ϊ6NA
C. ij�¶��£�1L pH=3�Ĵ�����Һϡ�͵�10Lʱ����Һ��H+����Ŀ����0.01NA
D. �����0.2 mol FeI2����Һ�г���ͨ��Cl2������0.1 mol Fe2��������ʱ��ת�Ƶ��ӵ���ĿΪ0.5NA ��(������Cl2��H2O�ķ�Ӧ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��84����Һ��ƿ�岿�ֱ�ǩ��ͼ��ʾ������84����Һ��ͨ��ϡ��100��(���֮��)��ʹ�á���ش��������⣺
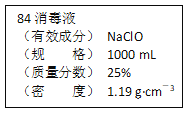
(1)����84����Һ�������ʵ���Ũ��ԼΪ_____mol��L��1��
(2)ȡ����������ĸ�����Һʱ�������������л�����ȡ����Ķ��ٶ��仯����________(����ĸ)��
A����Һ��NaClO�����ʵ��� B����Һ��Ũ��
C����Һ��NaClO��Ħ������ D����Һ���ܶ�
(3)��ͬѧ���ĸ���84����Һ�����䷽������NaClO��������480 mL��NaClO��������Ϊ25%������Һ���ش��������⡣
����ͼ��ʾ�������У���Щ�Dz���Ҫ������������Һ����Ҫ��������_______
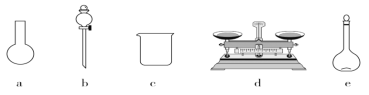
����Ҫ����NaClO���������Ϊ_______ g
(4)��84����Һ����ϡ������ʹ�ÿ���ǿ����������ij����С����Ա��98%(�ܶ�Ϊ1.84 g��cm��3)��Ũ��������200 mL 2.3 mol��L��1��ϡ����������ǿ��84����Һ��������������
�������Ƶ�ϡ�����У�H�������ʵ���Ũ��Ϊ________mol��L��1��
������Ũ��������Ϊ________ mL��
���������Ƶ�ϡ����Ũ��ƫС�������п��ܵ�ԭ���������ȷ����_______��
A������ǰ������ƿ������������ˮ B����ȡŨ����ʱ������Һ��İ�Һ��
C��δ��ȴ������ת��������ƿ���� D������ʱ��������Һ�İ�Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ϻ�ʵ�ʲ����ڹ�ҵ�������ǣ� ��
A.Na��![]() ��ȼ����NaClB.Ũ
��ȼ����NaClB.Ũ![]() ��NaCl��Ӧ��HCl
��NaCl��Ӧ��HCl
C.![]() ��ʯ����������Ư�۾�D.H2��
��ʯ����������Ư�۾�D.H2��![]() ��ֻ�Ϲ�����HCl
��ֻ�Ϲ�����HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦCH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ��H>0,���������CH4ƽ��ת���ʵ�������
2CO(g)+2H2(g) ��H>0,���������CH4ƽ��ת���ʵ�������
A. ���µ�ѹ B. ���¸�ѹ C. ���¸�ѹ D. ���µ�ѹ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com