
【题目】下列仪器①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥量筒⑦燃烧匙。常用于物质分离的是
A. ①②⑥ B. ①③④ C. ①③⑤ D. ③④⑦
科目:高中化学 来源: 题型:
【题目】下列反应中,通入的气体物质只作为氧化剂的是
A.二氧化硫通入溴水溶液中B.氯气通入氯化亚铁溶液中
C.一氧化碳气体通入灼热的CuO中D.二氧化氮通入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
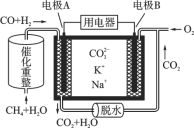
A. 反应CH4+H2O![]() 3H2+CO,每消耗1 mol CH4 转移2 mol 电子
3H2+CO,每消耗1 mol CH4 转移2 mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-===2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
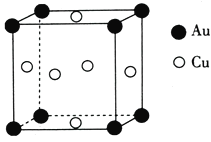
【题目】铜的相关化合物在生产生活中具有重要的作用。回答下列问题:
(1)铜元素在周期表中的位置是______,基态铜原子中,核外电子占据最高能层的符号是______,占据该最高能层的电子数为__________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于__________(填“晶体”或“非晶体”)。
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为_____________。硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是异硫氰酸(H-N=C=S)。理论上前者沸点低于后者,其原因是____________________________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子个数为________。
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为____![]() 用含a、NA的代数式表示)gcm-3。
用含a、NA的代数式表示)gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 用浓盐酸分别和KMnO4、KClO3反应制备l mol氯气,转移的电子数均为2NA
D. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是

A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是H+)和水分子通过。其工作原理的示意图如下,请回答下列问题:
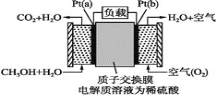
(1)该装置的能量转化形式为________。
(2)Pt(a)电极是电池________(填“正”或“负”)极;
(3)电解液中的H+向_____(填“a”或“b”)极移动;
(4)如果该电池工作时消耗1 mol CH3OH,则电路中通过___ mol电子。
(5)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com