
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题分析 (1)根据反应物总能量和生成物总能量的关系判断反应热,反应焓变等于断裂化学键吸收的能量减去形成化学键放出的能量;
(2)反应热和起始物质和终了物质能量有关和变化过程无关,反应为放热反应,升温平衡逆向进行;
(3)催化剂改变反应速率降低反应的活化能,不改变化学平衡;
(4)加入催化剂后该反应的活化能降低,但得到平衡状态相同;
解答 解:(1)由图象可以看出反应物总能量大于生成物的总能量,则该反应的正反应为放热反应,反应的焓变为负值,△H=-(E2-E1),
故答案为:大于,△H=-(E2-E1);
(2)E1为反应的活化能,反应的反应热和起始物质和终了物质能量有关和变化过程无关,活化能改变反应速率不影响反应热,反应为放热反应,当反应达到平衡时,若升高温度,平衡逆向进行,A的转化率减小,
故答案为:无,减小;
(3)在反应体系中加入催化剂,反应速率增大是因为,E1减小,活化分子数增多,有效碰撞次数增多,反应加快,
故答案为:减小,加入催化剂降低了反应的活化能,E1降低,同时活化分子数增多,有效碰撞次数增多,反应加快;
(4)催化剂降低反应的活化能,加快反应速率,是改变反应速率不改变化学平衡,在如图中画出加入催化剂后该反应的能量图为: ,
,
故答案为: ;
;
点评 本题考查反应热的判断,影响化学反应速率的因素,图象的绘制和分析,注意催化剂改变反应速率不改变化学平衡,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥⑦⑧ | D. | ⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H3>△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为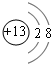 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe( N03)3溶液中加入过量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 浓烧碱溶液中加入铝片:2A1+20H-═2AlO2-+H2 | |
| C. | H2SO4与Ba(OH)2溶液反应:Ba2+OH-+H++SO42-═BaSO4+H2O | |
| D. | 将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com