
| A. | 20 mol | B. | 10 mol | C. | 5 mol | D. | 30 mol |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )| A. | 正反应吸热,A是气体 | B. | 正反应吸热,A是固体 | ||
| C. | 正反应放热,A是气体 | D. | 正反应放热,A是固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
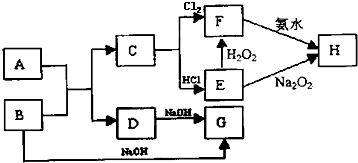
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g乙烯和28g丙烯中均含有6NA对共用电子对 | |
| B. | 标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA | |
| C. | 标准状况下,560 mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.2NA | |
| D. | 11.2L乙烯、乙炔的混合物中C原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 许多金属和合金具有低温下失去电阻的特性,即具有超导性 | |
| B. | 两个较轻的原子核聚合为一个较重的原子核时要释放出大量的能量,所释放的能量可用于发电 | |
| C. | 天然的、人为的各种电磁波干扰和有害的电磁辐射会造成电磁污染 | |
| D. | 美国科学家利用分子组装技术研制出世界上最小的“纳米算盘”,该算盘的算珠由球形C60分子构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年1月4日,国家首次将雾霾天气纳入自然灾情进行通报.雾霾也是一种分散系,分散剂为空气 | |
| B. | 氯化氢溶于水的过程中虽然有H-Cl键的断裂,但没有新化学键的形成,所以该过程是物理过程 | |
| C. | 2014年12月某市某化工市场发生爆炸,据调查为化工原料“醋酸乙烯”燃烧所致,该化工原料属于烯烃 | |
| D. | 2014年的诺贝尔化学奖授予了超高分辨率荧光显微镜的发展者,该技术突破了光学显微镜的极限,能观察到纳米尺度的微粒,该技术还可以将研究反应速率的时间分辨率达到纳秒级水平 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com