
【题目】已知A~K均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。

请回答以下问题:
(1)C是__,G是__。(填化学式)
(2)H生成I反应的化学方程式为__。
(3)向F中通入过量CO2生成K的离子方程式为__。
(4)E的溶液可以做净水剂,用离子方程式和必要的文字解释其净水原理:_____。
【答案】Al2O3 FeCl3 4Fe(OH)2+O2+2H2O=4 Fe(OH)3 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 氯化铝溶液中铝离子水解(Al3++3H2O= Al(OH)3(胶体)+3H+),生成氢氧化铝胶体,具有吸附性,可用于净水
【解析】
D为金属单质,与盐酸反应生成氯化物G,加入氢氧化钠可生成氢氧化物H,H在空气中变为红褐色固体,可知I为氢氧化铁,那么H为氢氧化亚铁,G为氯化亚铁,D为铁,红褐色I氢氧化铁与盐酸反应生成氯化铁,即J为氯化铁,氯化铁与铁反应可生成G氯化亚铁;高温下A与B反应生成铁,可知发生的是铝热反应,那么A为Al,B为氧化铁,得知C为Al2O3,与盐酸反应生成E氯化铝,加入过量氢氧化钠可完全溶解生成F偏铝酸钠,通入过量CO2可生成K白色沉淀Al(OH)3,受热可分解为C,据此回答问题。
D为金属单质,与盐酸反应生成氯化物G,加入氢氧化钠可生成氢氧化物H,H在空气中变为红褐色固体,可知I为氢氧化铁,那么H为氢氧化亚铁,G为氯化亚铁,D为铁,红褐色I氢氧化铁与盐酸反应生成氯化铁,即J为氯化铁,氯化铁与铁反应可生成G氯化亚铁;高温下A与B反应生成铁,可知发生的是铝热反应,那么A为Al,B为氧化铁,得知C为Al2O3,与盐酸反应生成E氯化铝,加入过量氢氧化钠可完全溶解生成F偏铝酸钠,通入过量CO2可生成K白色沉淀Al(OH)3,受热可分解为C;
(1)由分析可知C为Al2O3,G是FeCl3;
(2)H为氢氧化亚铁被氧气氧化后生成红褐色的氢氧化铁,反应方程式为4Fe(OH)2+O2+2H2O=4 Fe(OH)3;
(3)向偏铝酸钠溶液中通入过量的CO2,生成氢氧化铝白色沉淀,离子反应为:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)E为氯化铝,铝离子水解生成氢氧化铝胶体,具有吸附性,可用于净水,反应为:Al3++3H2O= Al(OH)3(胶体)+3H+。


科目:高中化学 来源: 题型:
【题目】向一定量Fe、FeO、Fe2O3的混合物中,加入50mL1mol·L-1硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A. 11.2g B. 2.8g C. 5.62g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)下列有机物说法不正确的是( )
A. BrCH2CHBrCH2Br的名称为三溴丙烷
B. 萘环上的一个H原子被-C4H9取代后的产物共有8种
C. 对甲基苯乙烯中最多有17个原子共面
D. 纤维素和淀粉都是多糖,它们彻底水解后的产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种香料,可采用丙烯和甲苯为主要原料按下列路线合成:
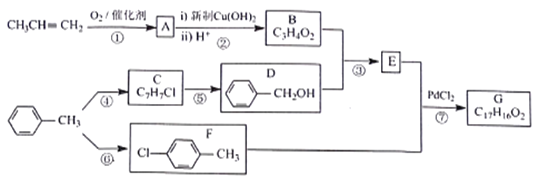
已知:①A的相对分子质量为56,其中氧的质量分数为28.6%
回答下列问题:
(1)A的分子式为___________,F的名称是__________
(2)B中含有的官能团名称为 __________________
(3)③的反应类型为_____________,反应⑤的试剂及条件为___________
(4)反应⑦的化学方程式为__________________
(5)X比D多1个CH2原子团,X的同分异构体中,能与FeCl3溶液发生显色反应的有______种,写出一种属于D的同系物且能发生消去反应的X的结构简式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. O2、O3 是氧元素的同素异形体,性质都相似
B. 35Cl与37Cl-互为同位素
C. 乙二醇( ![]() ) 和甘油(
) 和甘油( ![]() )互为同系物
)互为同系物
D. CH3CHO 与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟(49In)与铷(37Rb)同周期。下列说法错误的是
A. In原子核外有5个电子层B. ![]() In的中子数与电子数的差值为17
In的中子数与电子数的差值为17
C. 碱性:In(OH)3<RbOHD. 原子半径:In>Rb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轴烯、旋烷是一类具有张力的碳氢化合物,结构如图所示。下列说法错误的是

A. 旋烷的通式为C3n+6H4n+8(n≥1)
B. 轴烯①、轴烯②、轴烯③、轴烯④之间不属于同系物
C. 轴烯①的二氯代物只有3种(不考虑立体异构)
D. 1mol旋烷④转化为C18H36,需消耗6molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。
Ⅰ.制备苯甲酸和回收未反应的甲苯
反应原理:

第1步:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应;
第2步:过滤反应混合物,得到滤液;经过操作Ⅰ,得到有机层和水层;
第3步:向有机层中加无水Na2SO4,过滤,经过操作Ⅱ,得到无色液体A;
第4步:向水层加入浓盐酸酸化,蒸发浓缩,冷却,过滤,得到白色固体B;
已知:
相对分子质量 | 熔点 | 沸点 | 密度 | 溶解度 | |
甲苯 | 92 | -95℃ | 110.8℃ | 0.8669g·mL-1 | 极微溶于水 |
苯甲酸 | 122 | 122.4℃ | 249℃ | 1.2659 g·mL-1 | 0.3g (25℃时) 6.9g (95℃时) |
(1)操作Ⅰ所用的玻璃仪器有烧杯和______________,操作Ⅱ为________________。
(2)第3步中加入无水Na2SO4的目的是_____________________,无色液体A是_______。
Ⅱ.提纯粗苯甲酸
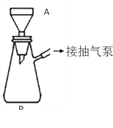
(3)该同学利用重结晶的方法对得到的B进行提纯。重结晶的过程:__________→_________ →_______ →抽滤(与过滤类似)→洗涤→干燥→纯苯甲酸。(注:抽滤装置如图所示,主要仪器有A布氏漏斗,B抽滤瓶,抽气泵等)
(4)白色固体B中的杂质是____________。
(5)趁热抽滤得到的滤液放置冷却可以结晶出纯净的苯甲酸晶体,为了得到更多的苯甲酸,是不是温度越低越好并说明理由______(填“是”或“不是”),理由___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的工作原理:
ⅰ.充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
ⅱ.放电过程原理示意图如图所示:

①放电时,电流从______(填“a”或“b”)极流出。
②充电时,a极的电极反应式为______。
(2)钴酸锂回收再生流程如下:

①用H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是______。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:会产生有毒、有污染的气体。写出相应反应的化学方程式_______。
③其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30% H2O2 混合液中的浸出率曲线如图,请解释温度高于80℃,钴的浸出率变化的原因:______。

④高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com