
| A. | 1.5g-CH3中含有的电子数为6.02×1023 | |
| B. | 标准状况下.22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 | |
| C. | 工业上用电解法精炼粗铜时,每转移1mo1电子,阳极上溶解的铜原子数必为0.5×6.02×1023 | |
| D. | VL amo1•L-1氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023. |
分析 A.甲基的摩尔质量为15g/mol,甲基中含有9个电子;
B.二者恰好反应生成1mol二氧化氮,由于部分二氧化氮转化成四氧化二氮,导致气体的总物质的量减小;
C.阳极中含有杂质铁、锌等较活泼金属,电解时优先放电,则溶解的铜的物质的量减小;
D.铁离子部分水解,则溶液中氯离子的数目大于铁离子数目的3倍.
解答 解:A.1.5g甲基的物质的量为:$\frac{1.5g}{15g/mol}$=0.1mol,0.1mol甲基中含有0.9mol电子,含有的电子数为6.02×0.9×1023,故A错误;
B.标准状况下,22.4L NO和11.2L O2混合后生成22.4L二氧化氮,二氧化氮的物质的量为1mol,由于部分二氧化氮转化成四氧化二氮,则反应后气体的分子总数小于1.0×6.02×1023,故B错误;
C.工业上用电解法精炼粗铜时,每转移1mo1电子,阳极上失去1mol导致,由于杂质Fe、Zn优先放电,则溶解的铜原子的物质的量小于0.5mol,铜原子数小于0.5×6.02×1023,故C错误;
D.VLamo1•L-1氯化铁溶液中,铁离子部分水解,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;B为易错点,注意二氧化氮与四氧化二氮之间存在转化关系.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
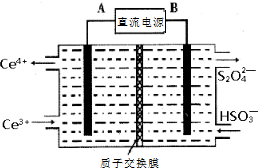
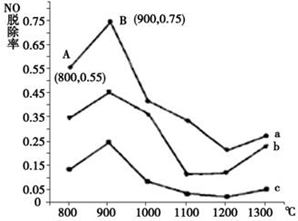 硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.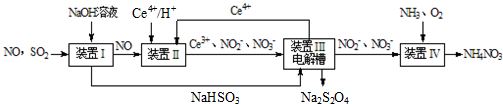
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+═H2SiO3(胶体) | |
| B. | FeI2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量NaHSO4 溶液与Ba(OH)2 溶液反应:H++OH-+SO42-+Ba2+═H2O+BaSO4↓ | |
| D. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式符合XY2型的化合物可能由同一主族元素构成 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 所有的非金属元素都位于元素周期表的右半区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
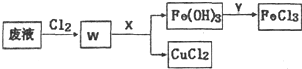
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
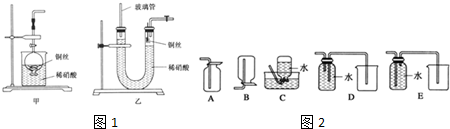
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 消耗盐酸一样多 | B. | 放出CO2一样多 | ||
| C. | 消耗盐酸前者多 | D. | 放出的CO2,第一份为第二份的一半 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com