
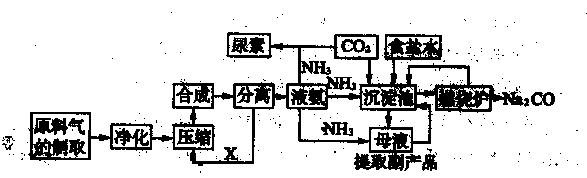
 2N2 + CO2 + 2H2O (1分)
2N2 + CO2 + 2H2O (1分)

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
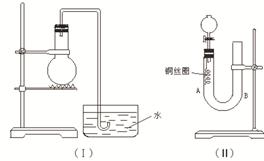
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.③①② | C.①③② | D.③②① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
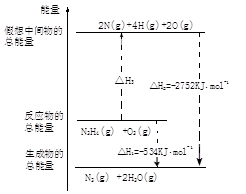
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3Cu(NO3)2 + 2NO↑+ 4H2O
3Cu(NO3)2 + 2NO↑+ 4H2O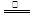 2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )
2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )| A.制取等量的硝酸铜,需硝酸的量②最少 |
| B.制取等量的硝酸铜,②产生的有毒气体比①少 |
| C.三种方案中,第③方案最经济环保 |
| D.三种方案的反应都可以在铁质容器中进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀硝酸能使红色石蕊试纸变蓝 |
| B.硝酸能与Na 2CO3反应,但不能生成CO2 |
| C.硝酸的氧化性很强,能氧化所有金属 |
| D.浓硝酸因分解放出NO2又溶解于硝酸而呈黄色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu+HNO3→ | B.N2+O2→ |
| C.NH3+O2→ | D.NO2+H2O→ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com