
分析 水的电离是吸热反应,升高温度促进水电离;该温度下,pH=11的NaOH溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L.
(1)如果混合溶液呈中性,则n(OH-)=c(H+);
(2)如果混合溶液pH=2,则混合溶液中c(H+)=0.01mol/L,c(H+)=$\frac{c({H}^{+})V({H}^{+})-c(O{H}^{-})V(O{H}^{-})}{V({H}^{+})+V(O{H}^{-})}$;
解答 解:水的电离是吸热反应,升高温度促进水电离,t℃时水的离子积为1×10-13>1×10-14,则该温度大于25℃,故答案为:>;
该温度下,pH=11的NaOH溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L.
(1)如果混合溶液呈中性,则n(OH-)=c(H+),所以0.01mol/L×xL=0.1mol/L×yL,x:y=10:1;此时溶液中的溶质为Na2SO4溶液,离子浓度大小关系为:c(Na+)>c(SO42-)>c(H+)=c(OH-),故答案为:10:1;c(Na+)>c(SO42-)>c(H+)=c(OH-);
(2)如果混合溶液pH=2,则混合溶液中c(H+)=0.01mol/L,c(H+)=$\frac{c({H}^{+})V({H}^{+})-c(O{H}^{-})V(O{H}^{-})}{V({H}^{+})+V(O{H}^{-})}$=$\frac{0.1mol/L×yL-0.01mol/L×xL}{(x+y)L}$=0.01mol/L,x:y=9:2;
设氢氧化钠溶液的体积为9L,则硫酸溶液的体积为2L,故n(NaOH)=CV=0.01mol/L×9L=0.09mol;n(H2SO4)=CV=$\frac{0.1mol/L}{2}×2L$=0.1mol
两者混合后溶液显酸性,故溶液中的离子浓度大小关系为:c(SO42-)>c(Na+)>c(H+)>c(OH-);
故答案为:9:2;c(SO42-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查了酸碱混合后溶液pH的有关计算和离子浓度大小比较,难度不大,应注意温度对水的离子积以及pH计算的影响.


科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:乙>丙>丁>甲 | |
| B. | 简单气态氢化物的稳定性:甲>丁,这是因为甲的氢化物分子间存在氢键 | |
| C. | 甲和丁组成的化合物在熔融状态下可以导电 | |
| D. | 乙、丙、丁的最高价氧化物对应的水化物均能两两反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 托卡朋的分子式为C14H12NO5 | |
| B. | 反应AB的类型属于氧化反应 | |
| C. | 托卡朋分子中所有的碳原子不可能在同平面内 | |
| D. | 托卡朋不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl | B. | NH4HSO4 | C. | CH3COONH4 | D. | (NH4)2Fe(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
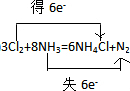 .
.| 碘水的体积(mL) | 标况下氯气的体积(mL) |
| 500 | 56 |
| 500 | 55 |
| 500 | 57 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是①能与溴水发生取代反应 ②能使酸性KMnO4溶液褪色 ③1mol该物质最多能与4mol H2加成 ④1mol该物质最多能与含2mol NaOH的溶液反应( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是①能与溴水发生取代反应 ②能使酸性KMnO4溶液褪色 ③1mol该物质最多能与4mol H2加成 ④1mol该物质最多能与含2mol NaOH的溶液反应( )| A. | ①②③ | B. | ①③④ | C. | ③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量 | |
| B. | 1 mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270 kJ | |
| C. | 在相同条件下,形成2 mol HF(g)的化学键所释放的总能量大于断裂1 mol H2(g)和1 mol F2(g)的化学键所吸收的总能量 | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 例 | 影响速率的因素 | 如何影响 |
| 鲜牛奶变酸:28℃约4h,5℃约48h | ||
| 硫在氧气中比在空气中燃烧快 | ||
| 碳酸钙与盐酸反应:粉状比块状快 | ||
| KClO3与MnO2混合共热可快速产生O2 | ||
| 工业合成氨通常要在高压下进行 | . |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com