

分析 装置A:为二氧化碳发生装置,CaCO3+2H+=Ca2++H2O+CO2↑;装置B:用饱和的碳酸氢钠溶液,除去二氧化碳中的HCl,装置C:为干燥装置,用浓H2SO4吸收二氧化碳中的水蒸气,装置D:钠与二氧化碳反应,可能发生4Na+3CO2$\frac{\underline{\;高温\;}}{\;}$2Na2CO3+C或2Na+2CO2$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO;钠为活泼金属,反应需要排尽装置内的空气,装置E:当E装置中产生白色沉淀,说明空气中的二氧化碳排尽,再加热D处的酒精灯发生反应;装置F:若装置F中溶液无明显变化,取少量固体生成物与足量的盐酸反应后,有能使澄清石灰水变浑浊的气体放出,且固体有剩余,发生:4Na+3CO2$\frac{\underline{\;高温\;}}{\;}$2Na2CO3+C;若装置F中有黑色沉淀生成,取少量该固体与足量的盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,且固体无剩余,发生2Na+2CO2$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO,
(1)实验室常用碳酸钙与稀盐酸反应制取二氧化碳,制取气体的装置能“随开随用,随关随停”,是利用的启普发生器原理分析选择装置,制得的二氧化碳中含有氯化氢和水蒸气,利用装置B除氯化氢,利用装置C除水蒸气;
(2)装入药品后,在点燃酒精喷灯前,需要先把装置中空气排出,再点燃酒精喷灯;
(3)①装置F中无明显现象,证明没有CO生成,装置D中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C;
②装置D中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置F中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应产物为碳酸钠和CO.
解答 解:(1)实验室常用碳酸钙与稀盐酸反应制取二氧化碳,反应方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;制取气体的装置能“随开随用,随关随停”,是利用的启普发生器原理分析选择装置;制得的二氧化碳中含有氯化氢和水蒸气,利用装置B饱和NaHCO3除氯化氢,利用装置C浓H2SO4除水蒸气;
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;Ⅲ;饱和NaHCO3;浓H2SO4;
(2)装入药品后,在点燃酒精喷灯前,需要先把装置中空气排出,打开Ⅲ的导气管活塞,先通一会CO2气,待装置E中出现澄清的石灰水变浑浊现象时,再点燃酒精喷灯;
故答案为:高温; E;澄清的石灰水变浑浊;排出该装置中的空气;
(3)①装置F中无明显现象,证明没有CO生成,装置D中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,
其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2$\frac{\underline{\;高温\;}}{\;}$2Na2CO3+C;
故答案为:4Na+3CO2$\frac{\underline{\;高温\;}}{\;}$2Na2CO3+C;
②由题意可知,装置D中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,
装置F中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应产物为碳酸钠和CO,反应的化学方程式为2Na+2CO2$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO;
故答案为:2Na+2CO2$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO.
点评 本题考查了实验装置的选择,物质性质的实验设计验证分析应用,主要是钠及其化合物性质的判断理解,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得 0.1mol/L NH4Cl溶液的pH=5.2 | |
| B. | 酸碱中和滴定时锥形瓶用蒸馏水洗涤后,再用待测液润洗后装液进行滴定 | |
| C. | 将碘水倒入分液漏斗,加入适量苯振荡后静置,从分液漏斗下口放出碘的苯溶液 | |
| D. | 常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 125 mL | B. | 275 mL | C. | 325 mL | D. | 450 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
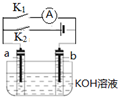
| A. | 断开K2,闭合K1一段时间,溶液的pH要变大 | |
| B. | 断开K1,闭合K2时,b极上的电极反应式为 2H++2e-═H2↑ | |
| C. | 断开K1,闭合K2时,OH-向b极移动 | |
| D. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 | B. | 24 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
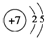 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
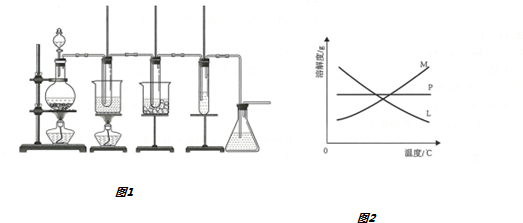
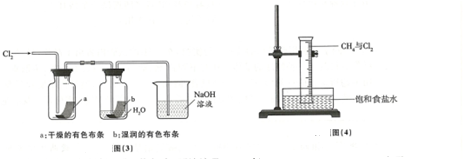
| 实验现象 | 原因 |
| 溶液从初的紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊试液变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+.Na+.NO3-.H+ | B. | NH4+.Fe3+.SO42-.SCN- | ||
| C. | SO42-.Cl-.Cu2+.Mg2+ | D. | Ba2+.K+.SO32-.H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com