
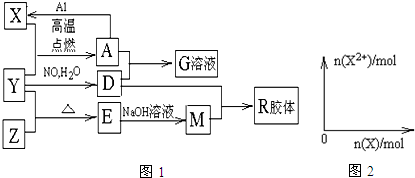
 .
.分析 A俗称磁性氧化铁,即为Fe3O4;能与氢氟酸反应且不溶于水的酸性氧化物是SiO2,即E为SiO2,根据框图中的转化关系,可知X为Fe、Y为O2、Z为Si、D为硝酸、M为Na2SiO3、G为硝酸铁,R为H2SiO3,结合对应的物质的性质以及题目要求可解答该题.
解答 解:A俗称磁性氧化铁,即为Fe3O4;能与氢氟酸反应且不溶于水的酸性氧化物是SiO2,即E为SiO2,根据框图中的转化关系,可知X为Fe、Y为O2、Z为Si、D为硝酸、M为Na2SiO3、G为硝酸铁,R为H2SiO3,
(1)组成单质Y的元素为O元素,原子核外有2个电子层,最外层电子数为6,位于元素周期表中第二周期,第ⅥA族,M为Na2SiO3,存在的化学键类型为离子键和共价键,R为H2SiO3,
故答案为:第二周期第ⅥA族;离子键和共价键; H2SiO3;
(2)Z为Si,Z与H2反应转化为SiH4,SiH4的电子式为 ,故答案为:
,故答案为: ;
;
(3)Fe3O4在高温下可与铝发生铝热反应,Fe3O4与1mol Al反应转化为Fe时(所有物质均为固体),放出akJ热量,则8molAl反应可以放出8aKJ的热量,所以热化学方程式为8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s),△H=-8a kJ/mol,
故答案为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s),△H=-8a kJ/mol;
(4)四氧化三铁和稀硝酸反应是氧化物中的二价铁元素被氧化到最高价,硝酸中氮元素被还原到+2价,反应的离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(5)铁和稀硝酸反应,开始铁全部被硝酸氧化为硝酸铁,故开始阶段Fe2+的量为0,随着铁的加入,多余的铁又和Fe3+反应而生成Fe2+,故Fe2+的量逐渐会增大直至到最大值,以后不变,反应过程中生成的气体为NO,令Fe2+的最大物质的量为xmol,根据电子转移守恒可知,NO的物质的量=$\frac{xmol×2}{3}$,根据N元素守恒可知:$\frac{xmol×2}{3}$+2x mol=4 mol,解得x=1.5,故n(Fe2+)随n(Fe)变化的示意图为: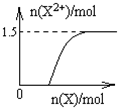 ,
,
故答案为: .
.
点评 本题考查无机物的推断,侧重物质转化和性质的考查,侧重铝热反应及硅及其化合物转化的考查,(5)为易错点,注意根据反应的方程式计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
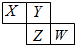 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )| A. | 最高价氧化物对应水化物的酸性:W>Z | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 4种元素的单质中,Z单质的熔、沸点最高 | |
| D. | W单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②④⑥ | C. | ①②⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 方框中的物质应为 Cu2S | |
| B. | 若有1 molSO2生成,则反应中有4 mol 电子转移 | |
| C. | SO2既是氧化产物又是还原产物 | |
| D. | O2只作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(s) | B. | CH3COONa(s) | C. | FeCl3(s) | D. | NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
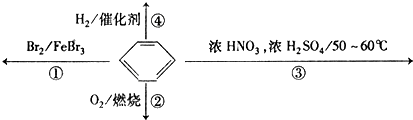
| A. | 反应①为取代反应,有机产物的密度比水小 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟 | |
| C. | 反应③为取代反应,有机产物是一种烃 | |
| D. | 反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳酸双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com