
 xC(g) ��H = QKJ/mol
xC(g) ��H = QKJ/mol xc(g)�ﵽƽ�⣬��ʱ��üס�����������C�����������Ϊ0.2 ��
xc(g)�ﵽƽ�⣬��ʱ��üס�����������C�����������Ϊ0.2 ��
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3C(g)����֪����1molA��3molB�Ҵﵽƽ�������amolC���ﵽƽ���C�ڷ�Ӧ������еİٷֺ�����
3C(g)����֪����1molA��3molB�Ҵﵽƽ�������amolC���ﵽƽ���C�ڷ�Ӧ������еİٷֺ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)+H2(g)����H�� �� �����ú���H1����H2�Ĵ���ʽ��ʾ��
CO(g)+H2(g)����H�� �� �����ú���H1����H2�Ĵ���ʽ��ʾ�� CH3OH��g������H3�������ݻ���Ϊ1L��a��b��c��d��e����ܱ������зֱ����1mol CO��2mol H2�Ļ�����壬���£�����ʵ�飬��������������ͼ1��ͼ2��
CH3OH��g������H3�������ݻ���Ϊ1L��a��b��c��d��e����ܱ������зֱ����1mol CO��2mol H2�Ļ�����壬���£�����ʵ�飬��������������ͼ1��ͼ2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ�
xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Z��g��+2 W��g����H<0����Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����
Z��g��+2 W��g����H<0����Ӧ���е�5sʱ���X��ת����Ϊ25%��10 s��ﵽ��ѧƽ�⣬���Z��Ũ��Ϊ0.5mol/L��������˵����ȷ����| A��5s��ƽ����Ӧ����Ϊ��(Y)=" 0.2" mol/( L��s) |
| B���÷�Ӧ��ƽ�ⳣ����ֵΪ0.5 |
| C�������ݻ�������䣬��������ͨ������������߷�Ӧ���ת���� |
| D�������¶ȣ�������������ܶȲ���ʱ����ʾ�÷�Ӧ�Ѿ��ﵽƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 �������ﵽ��ѧƽ��ʱ����������˵������ȷ���м��֣��� ��
�������ﵽ��ѧƽ��ʱ����������˵������ȷ���м��֣��� �� | A��3�� | B��4�� | C��5�� | D��6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼ״̬��Ϊc��A����0��100 mol��L��1��c��B����0��200mol��L��1��c��C����0 mol��L��1. �����������£���Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ��
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼ״̬��Ϊc��A����0��100 mol��L��1��c��B����0��200mol��L��1��c��C����0 mol��L��1. �����������£���Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ��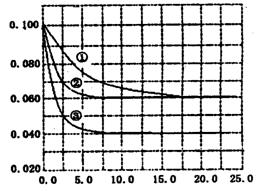
 C�ġ�H>0
C�ġ�H>0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g)���������ͨ��4 mol A��2 mol
xC(g)���������ͨ��4 mol A��2 mol  B����ƽ��ʱ�������C���������Ϊ40%����������ͨ��1 mol A��0.5 mol B��3 mol C��ƽ��ʱ���C���������ΪW%���Իش�
B����ƽ��ʱ�������C���������Ϊ40%����������ͨ��1 mol A��0.5 mol B��3 mol C��ƽ��ʱ���C���������ΪW%���Իش��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com