
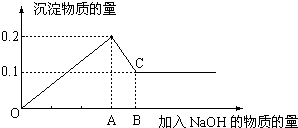
| 组序 成分 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
分析 (1)Cu、Fe的混合物与稀硝酸反应,金属可能有剩余,可能没有剩余.金属剩余时可能是Fe、Cu或者只有Cu,根据剩余固体的成分结合物质还原性强弱、离子共存分析;
(2)当溶液中的金属离子只有Fe2+、Cu2+时,说明Cu恰好完全反应或者有剩余,而HNO3和Fe则完全反应(如果有硝酸剩余,则Fe2+则会被进一步氧化为Fe3+;如果有Fe剩余,则会和Cu2+继续反应),
HNO3→NO,N得3电子,设被还原的HNO3为y mol,总计得3y mol电子,
Cu→Cu2+,Cu失2电子,设参加反应的Cu为z mol,总计失2z mol电子,
Fe→Fe2+,Fe失2电子,参加反应的Fe为a(1-x) mol,总计失2a(1-x) mol电子,
根据得失电子总数相等,所以:3y=2z+2a(1-x) ①
反应中起酸作用的硝酸生成Fe(NO3)2和Cu(NO3)2,起氧化剂作用的硝酸生成NO,由N元素守恒,所以有:y+2a(1-x)+2z=b ②
联立方程,消去y,可得b的表达式(用a、x、z表示),参加反应的Cu的物质的量z的取值大于0,最大为ax,带入b的表达式计算.
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,Cu全部为铜离子,根据得失电子守恒和氮原子守恒计算.
解答 解:(1)Cu、Fe的混合物与稀硝酸反应,金属可能有剩余,可能没有剩余.金属可能有剩余时,根据共存可知,剩余金属有两种情况:①剩余Fe、Cu,当有Fe剩余时,溶液中能与Fe反应的Fe3+、Cu2+都不存在,所以溶液中只有Fe2+;
②只剩余Cu,溶液中一定不存在与Cu反应的Fe3+,根据离子共存,可能只有Fe2+;
③通过②知,溶液中还可能存在的离子是Fe2+、Cu2+;
④当固体没有剩余时,可能存在的情况是:当Fe恰好与硝酸反应生成Fe2+,Cu 恰好与硝酸生成Cu2+,所以溶液中存在的离子是Fe2+、Cu2+;
⑤通过④知,固体没有剩余时,生成的Fe3+部分反应,根据离子共存,溶液中存在的离子可能的Fe2+、Fe3+、Cu2+;
⑥通过④、⑤知,固体没有剩余时,铁、铜全部被氧化成离子,根据离子共存,溶液中存在的离子可能是Cu2+、Fe3+;
故答案为:
| 组序 成分 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 残留固体成分 | Fe、Cu | Cu | Cu | |||
| 溶液中的金属离子 | Fe2+ | Fe2+ | Fe2+、Cu2+ | Fe2+、Cu2+ | Fe2+、Fe3+、Cu2+ | Cu2+、Fe3+ |
点评 本题考查了铁、铜及硝酸的性质,因为铁是变价金属,和硝酸反应又涉及量不同产物不同,所以本题难度较大,可根据固体成分结合离子共存讨论,化繁为简,效果较好.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol | B. | 0.1mol | C. | 0.2mol | D. | 0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m>n | B. | m=n | C. | m<n | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上大量含硫燃料的燃烧 | B. | 工业生产使空气中CO2含量增加 | ||
| C. | SO2在尘埃催化下氧化为SO3 | D. | SO3与水反应生成H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
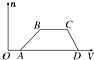 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.
某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 制取
制取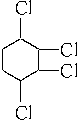 ,其合成流程如下:
,其合成流程如下: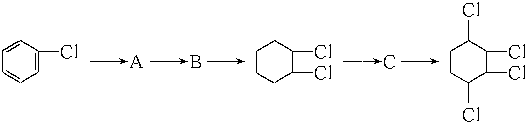
 这两步反应的化学方程式.
这两步反应的化学方程式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com