
| 溶解 |
| 沉淀 |
| 1.8×10-10 |
| 0.02 |


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
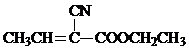 )是合成某种手术用粘合剂的单体,X的合成路线如图:
)是合成某种手术用粘合剂的单体,X的合成路线如图: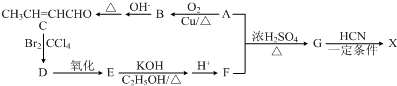

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在制备乙烯的实验中,为了防止反应产生副产物,加热时应使温度迅速上升至170°C |
| B、分别向三支盛有乙酸乙酯的试管中加入氢氧化钠溶液、稀硫酸、水,并在水浴中加热,乙酸乙酯香味散失的速度按氢氧化钠、水、稀硫酸的顺序依次减慢 |
| C、将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 |
| D、向苯酚钠稀溶液中,通入少量二氧化碳气体,溶液中生成碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeCl2 溶液中逐滴加入NaOH溶液 |
| B、向FeSO4溶液中逐滴加入氨水 |
| C、先将盛有NaOH溶液的长滴管插到FeSO4液面下,再挤出NaOH溶液可制得Fe(OH)2的白色沉淀 |
| D、取新配制的FeSO4溶液适量放入试管中,在加入一层植物油(密度小于水,且不溶于水),然后向试管内逐滴加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.查看答案和解析>>
科目:高中化学 来源: 题型:
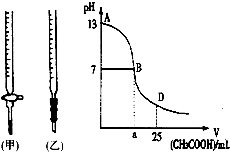 图为向25mL0.1mol?L-1NaOH溶液中逐渐滴加0.2mol?L-1CH3COOH溶液过程中,用pH计跟踪测出溶液pH的变化曲线,请回答:
图为向25mL0.1mol?L-1NaOH溶液中逐渐滴加0.2mol?L-1CH3COOH溶液过程中,用pH计跟踪测出溶液pH的变化曲线,请回答:| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 甲基橙 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:2 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com