氮的氢化物NH
3、N
2H
4等在工农业生产、航空航天等领域有广泛应用.
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
向Cu
2+、Mg
2+、Fe
3+、Fe
2+浓度都为0.01mol?L
-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为
(用化学式表示).
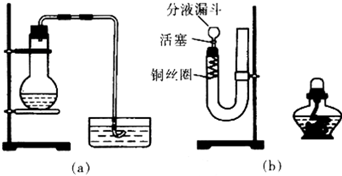
(2)实验室制备氨气的化学方程式为
.工业上,制备肼(N
2H
4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应.以石墨为电极,将该反应设计成原电池,该电池的负极反应为
.
(3)在3L密闭容器中,起始投入4mol N
2和9mol H
2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
已知:破坏1mol N
2(g)和3mol H
2(g)中的化学键消耗的总能量小于破坏2mol NH
3(g)中的化学键消耗的能量.
①则T
1
T
2(填“>”、“<”或“=”)
②在T
2K下,经过10min达到化学平衡状态,则0~10min内H
2的平均速率v(H
2)=
,平衡时N
2的转化率α(N
2)=
.若再增加氢气浓度,该反应的平衡常数将
(填“增大”、“减小”或“不变”)
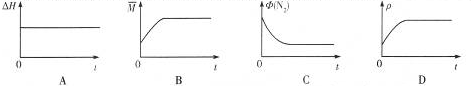
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量(
)、N
2体积分数Φ(N
2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是
.




 根据如图回答问题:
根据如图回答问题: