
Fenton试剂常用于氧化降解有机污染物X。在一定条件下.反应初始时c(X)=2.0×10-3 mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是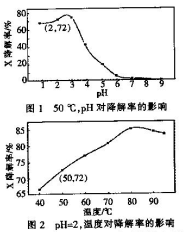
| A.50oC,PH在3~6之间,X降解率随PH增大而减小 |
| B.PH=2,温度在40~80 oC,X降解率温度升高而增大 |
| C.无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80 oC |
| D.PH=2、温度为50oC,10min内v(X)=1.44x10-4 mol·L-1min-1 |
科目:高中化学 来源: 题型:单选题
关于下列图像的叙述正确的是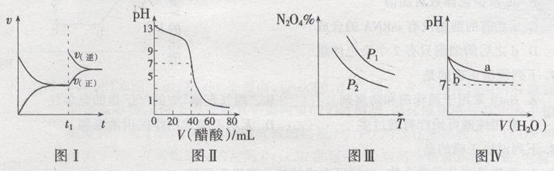
A.图I表示:反应I2(g)+H2(g)  2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度 2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度 |
| B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L |
C.图Ⅲ表示:反应2NO2(g)  N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2 N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2 |
| D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:CO2+H2(g)  CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO2)/mol | H2/ mol |
| 0 | 1.50 | 1.00 |
| t1 | | 0.40 |
| t2 | 0.90 | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
(1)已知:850 ℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示: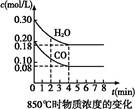
下列说法正确的是 (填序号)。
| A.达到平衡时,氢气的物质的量是0.12 mol |
| B.达到平衡时,反应体系最终会放出49.44 kJ热量 |
| C.第4 min时,混合气体的平均相对分子质量不再变化 |
| D.第6 min时,若升高温度,反应平衡常数会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化学反应速率的说法正确的是( )
| A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加 |
| B.化学反应速率为“0.8mol/(L·s)”所表示的意思是:时间为1s时,某物质的浓度为0.8mol·L-1 |
| C.根据化学反应速率的大小可以知道化学反应进行得快慢 |
| D.对于任何化学反应来说,反应速率越大,反应现象就越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在其他条件不变时,设某物质在10℃时反应速率为3mol·(L·s)-1,每升高10℃,反应速率是原来的3倍,那么50℃,反应速率是( )
| A.9mol·(L·s)-1 | B.27mol·(L·s)-1 |
| C.81mol·(L·s)-1 | D.243mol·(L·s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下的恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
| A.该反应的焓变和熵变:ΔH>0,ΔS<0 |
| B.温度降低,该反应的平衡常数K增大 |
| C.升高温度,n(CH3OH)/n(CO2)增大 |
| D.从反应开始到平衡,用氢气表示的平均反应速率为2.25 mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
| A.在该条件下,反应前后的压强之比为6?5.3 |
| B.若反应开始时容器体积为2 L,则有v(SO3)=0.35 mol/(L·min) |
| C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol |
| D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在容积恒定的密闭容器中,一定量的SO2与1.1 mol O2发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是( )
2SO3(g) ΔH<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是( )
| A.相同条件下,平衡时若充入稀有气体,SO2的转化率增大 |
| B.反应开始时,向容器中通入的SO2的物质的量是0.7 mol |
| C.保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| D.保持其他条件不变,仅缩小容器体积,反应达到平衡时容器中有1.485 mol气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com