

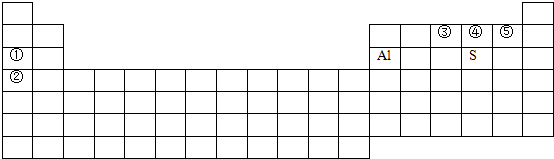
 ;
;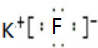 ;元素③氢化物为氨气,氨气分子中氮原子和每个氢原子之间存在一对共用电子对,其结构式为
;元素③氢化物为氨气,氨气分子中氮原子和每个氢原子之间存在一对共用电子对,其结构式为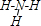 ;
;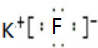 ;
;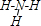 ;K;负;F;
;K;负;F;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、分液时,分液漏斗先从下口放出下层液体,换一烧杯再从下口放出上层液体 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶有大量晶体析出时就应停止加热 |
| D、称量时,称量物置于托盘天平的左盘,砝码放在托盘天平的右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室中的金属锂通常保存在盛有煤油的试剂瓶中,以便隔绝空气和水 |
| B、150mL 1mol?L-1NaCl溶液与75mL 1mol?L-1 NaHCO3溶液中Na+物质的量相等 |
| C、向FeCl3溶液中滴加KSCN溶液会产生血红色沉淀 |
| D、用洁净的铂丝蘸取样品在火焰上灼烧看见黄色火焰,说明样品中一定含钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
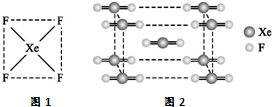 Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.查看答案和解析>>
科目:高中化学 来源: 题型:

| NaOH/H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
| ⑨ | ⑩ | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示.A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似.
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示.A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是非氧化还原反应 |
| B、每1摩尔LiH参与反应,电子转移2摩尔 |
| C、H2既是氧化产物,又是还原产物 |
| D、LiH既是氧化剂,又是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com