
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液480 mL:

(1)配制时,必须使用的玻璃仪器有胶头滴管、烧杯、玻璃棒、________。
(2)要完成本实验该同学应称出NaOH________g。
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为________g。
(4)使用容量瓶前必须进行的一步操作是________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
【答案】500 mL容量瓶 20 g 27.4 g 查漏 ④⑤
【解析】
(1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(2)利用n=cv计算出氢氧化钠的物质的量,再根据m=nM计算所需氢氧化钠的质量;
(3)托盘天平平衡原理为左盘内质量=右盘内质量+游码数值;
(4)最后需颠倒摇匀,所以容量瓶在使用前必须检查是否漏水;
(5)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=![]() 分析判断;
分析判断;
(1)没有480mL容量瓶,所以选择500mL容量瓶;操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀;所以需要的仪器有托盘天平、烧杯、500ml的容量瓶、胶头滴管、药匙,
故答案为:500ml的容量瓶;
(2)需氢氧化钠的质量为m=0.5L×1molL-1×40g/mol=20.0g,
故答案为:20.0g;
(3)由图可知,烧杯与砝码位置颠倒了,所以烧杯的实际质量为30.0g-2.6g=27.4g,
故答案为:27.4g;
(4)最后需颠倒摇匀,所以容量瓶在使用前必须检查是否漏水;
故答案为:查漏;
(5)①未洗涤烧杯、玻璃棒,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,溶液浓度偏低
②转移溶液时不慎有少量洒到容量瓶外面,移入容量瓶中的氢氧化钠的质量减小,所配溶液浓度偏低;
③最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
④定容时俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高;
⑤液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,温度恢复室温后,会导致溶液体积偏小,溶液浓度偏高;
⑥摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低;
故答案选④⑤。


科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。图是硫元素的常见化合价与部分物质类别的对应关系。
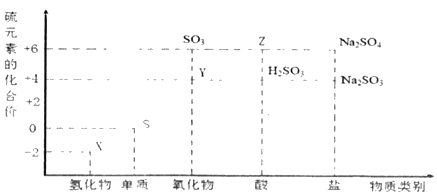
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的氧化物为_____(填化学式)。
(2)将X与Y混合可生成淡黄色固体,该反应的化学方程式为_____。
(3)Z的浓溶液与碳在一定条件下可以发生反应,体现了Z的_____性。
(4)写出硫与浓硫酸在加热条件下反应的化学方程式_____。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方法理论上可行的是_____(填字母)。
a.Na2SO3+S b.Na2S+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 测定盐酸和NaOH溶液反应的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应体系的最高温度
B. HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热 ΔH=2×57.3 kJ·mol1
C. 燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量
D. S(s)+ ![]() O2(g)
O2(g)![]() SO3(g) ΔH=315 kJ·mol1 表示S燃烧热的热化学方程式
SO3(g) ΔH=315 kJ·mol1 表示S燃烧热的热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2═2H2O,下列有关说法正确的是( )
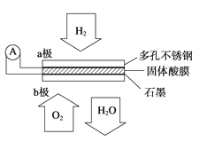
A. 电流通过外电路从a极流向b极
B. b极上的电极反应式为O2+2H2O+4e-═4OH-
C. 每转移0.2 mol电子,在负极上消耗标况下1.12 L的O2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00 mL 0.10 mol·L1一元弱碱MOH溶液中滴入0.10 mol·L1的盐酸,溶液的AG与所加盐酸的体积关系如图所示,已知AG = lg ![]() 。
。
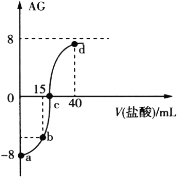
下列有关叙述不正确的是( )
A.50℃下,AG=0,此时溶液显中性
B.a点对应溶液中H2O电离出的c(H+)=1.0×1011 mol·L1
C.b点对应溶液中 4c(M+)+4c(MOH)=3c(Cl)
D.d点对应溶液中c(Cl)>c(H+)> c(M+)>c(MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。LiFePO4、聚乙二醇、LiPF6、LiAsF6和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
(1)Fe的价层电子排布式为___。
(2)Li、F、P、As四种元素的电负性由大到小的顺序为___。
(3)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是___。
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①聚乙二醇分子中,碳、氧的杂化类型分别是___、___。
②从化学键角度看,Li+迁移过程发生___(填“物理变化”或“化学变化”)。
③PF6中P的配位数为___。
④相同条件,Li+在___(填“LiPF6”或“LiAsF6”)中迁移较快,原因是___。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的品胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为___。LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则LiCl·3H2O晶体的密度为___g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有①分液漏斗②量筒③容量瓶,使用前需检查是否漏液的是___(填序号)
(2)___molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。
(3)标准状况下的四种气体:①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,密度最大的是___(填序号)
(4)10mL的CaCl2溶液里含2gCa2+,从中取出一半的溶液中Cl-的物质的量浓度是___。
(5)在Na2SO4和K2SO4的混合溶液中c(Na+)=0.2mol/L,c(SO42-)= amol/L,c(K+)=bmol/L时,a和b的关系是___。
(6)某物质A加热时按化学方程式2A=2B+C+3D分解,产物均为气体,测得由生成物组成的混合气体对H2的相对密度为20,则反应物A的摩尔质量为___。
(7)下列物质中:①铜 ②碳酸钙 ③氨气 ④氯气 ⑤空气 ⑥二氧化碳 ⑦氯化钠晶体 ⑧熔融硫酸钠。
属于电解质的是___, 非电解质的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
D. 分子式为C9H12的苯的同系物,若苯环上只有一个取代基,则其一溴代物最多有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见金属,部分反应物或生成物已略去。试根据图中转化关系,回答下列问题。
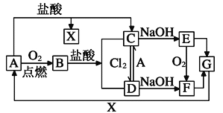
(1)B的俗名为____。
(2)保存C溶液时需加入少量A的原因是____,A与水蒸气反应的化学方程式为____,该反应类型属于____(填基本反应类型)
(3)E生成F可观察到的现象____,化学方程式为____。
(4)写出B→C化学方程式为____,C→D的离子方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com