
����Ŀ���ں����ܱ������д�������ƽ�⣺CO(g)+H2O(g) ![]() CO2(g)+H2(g)��CO2 (g)��ƽ�����ʵ���Ũ��c (CO2)���¶�T �Ĺ�ϵ��ͼ��ʾ������˵���������
CO2(g)+H2(g)��CO2 (g)��ƽ�����ʵ���Ũ��c (CO2)���¶�T �Ĺ�ϵ��ͼ��ʾ������˵���������
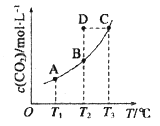
A.��ӦCO(g)+H2O(g) ![]() CO2(g)+H2(g)Ϊ���ȷ�Ӧ
CO2(g)+H2(g)Ϊ���ȷ�Ӧ
B.��T2ʱ������Ӧ����״̬D����һ���Ц���>����
C.ƽ��״̬A ��C ��-�ȣ�ƽ��״̬A ��c(CO)��
D.��T1��T2 ʱ��ƽ�ⳣ���ֱ�ΪK1��K2��K1> K2
���𰸡�BD
��������
A����ͼ��֪���¶�Խ��ƽ��ʱc (CO2)Խ��˵�������¶�ƽ��������Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ���У�������Ӧ�����ȷ�Ӧ������H��0��ѡ��A��ȷ��
B��T2ʱ��Ӧ���е�״̬D��c (CO2)����ƽ��Ũ�ȣ��ʷ�Ӧ���淴Ӧ���У���һ�������������������棩��ѡ��B����
C��ƽ��״̬A��C��ȣ�C���¶ȸߣ���֪��H��0�������¶�ƽ�����ƣ�COŨ�ȼ�С������A��COŨ�ȴ�ѡ��C��ȷ��
D���÷�Ӧ����Ӧ�����ȷ�Ӧ�������¶�ƽ��������Ӧ�ƶ�����ѧƽ�ⳣ������K1��K2��ѡ��D����
��ѡBD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ͭƬ����Ƭ��Cu��NO3��2��Һ��AgNO3��Һ�����ߺ����ţ�װ����֬��KNO3��U�ιܣ���Ƴ�һ��ԭ������ͼ��ʾ�������ж�����ȷ���ǣ� ��.

A.��ԭ��صĹ���ԭ����Cu��2Ag��=2Ag��Cu2��
B.ʵ�������ȡ�����ţ�ԭ����ܼ�������
C.ʵ������У�����ձ���NO3��Ũ�Ȳ���
D.ʵ������е�������Ϊ��Cu����Cu��NO3�� 2��Һ��AgNO3��Һ��Ag��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����С�������ֱ����������ı���ʳ��ˮ��ϡ������Һ�У�һ��ʱ���ɹ۲쵽��������
A.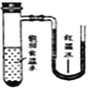 B.
B.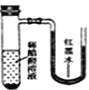 C.
C.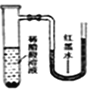 D.
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25�����������ʵ�pH��Ũ�����±���ʾ���ش��������⣺
��� | �� | �� | �� | �� |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
pH | 11 | 11 | 3 | 3 |
Ũ�� | c1 | c2 | c3 | c4 |
(1)c1____������>����<������=����c2��
(2)��Һ��ˮ�ĵ���̶���____������>����<������=��������
(3)�ֱ��ˮϡ��10����ϡ�ͺ�������Һ��pH�ɴ�С��˳��Ϊ____������ţ���
(4)����Һ������Һ�������ϣ���Һ��pH____7������>����<������=������������Һ�ζ�����Һ���ζ������в����ܳ��ֵĽ����____��
A. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C. c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E. c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(5)������ͭ����Һ��������ƽ�⣺Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq)�������£�Ksp=c(Cu2+)��c2(OH-)=2��10-20��ij����ͭ��Һ��c(Cu2+)=0.02 mol/L����Ҫ����Cu(OH)2������Ӧ������Һʹ֮pH>_____��
Cu2+(aq)+2OH-(aq)�������£�Ksp=c(Cu2+)��c2(OH-)=2��10-20��ij����ͭ��Һ��c(Cu2+)=0.02 mol/L����Ҫ����Cu(OH)2������Ӧ������Һʹ֮pH>_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨijŨ������Ʒ�����ʵ���Ũ�ȣ�����������ʵ�������
A.��ȴ�����º���100 mL����ƿ�ж������100 mLϡ���ᡣ
B.��ij������ȡ20.00 mLϡ��������ƿ�в����뼸��ָʾ����
C.����ʽ�ζ��ܺͼ�ʽ�ζ���������ˮϴ�Ӹɾ������ô�����Һ��ϴ��
D.�����ʵ���Ũ��ΪM mol/L�ı�NaOH��Һװ���ʽ�ζ��ܣ�����Һ����¿�ʼ����ΪV1 mL��
E.С�ĵ���NaOH����Һ���ߵα�ҡ����ƿ���ζ���ǡ�÷�ӦΪֹ�����¶���ΪV2 mL��
F.����ƿ�Ƶ���ʽ�ζ����£�����ƿ�µ�һ�Ű�ֽ��
G.��ij����ȷ��ȡŨ������Ʒ10.00 mL�����ձ���������ˮ�ܽ⡣
�ʹ�ʵ��������������գ�
(1)��ȷ���������˳���ñ����ĸ��д��___��A��___��___��___��F��___��
(2)������ȡ10.00 mLŨ�����������___����NaOH��Һ��ϴ��ʽ�ζ��ܵ�Ŀ����___��
(3)�ζ��п�ѡ�õ�ָʾ����___���ζ��У�Ŀ��Ӧ___���жϵζ��յ��������___������ʱ��Ŀ���밼Һ�����ʹ�����ˮƽ��
(4)ijѧ��ʵ��ʱ��ϡ������ϴ����ƿ���ⶨ��Ũ�Ȼ�ƫ___��(��ƫ�ߡ�����ƫ�͡�������Ӱ�족)��
(5)��Ũ������Ʒ��Ũ�ȼ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��㷺����ȼ�ϵ�ص�ȼ�ϣ�������Ȼ�����ϳɣ���֪��
��2CH4(g)��O2(g)===2CO(g)��4H2(g) ��H����71 kJ/mol
��CO(g)��2H2(g)===CH3OH(l) ��H����90.5 kJ/mol
��CH4(g)��2O2(g)===CO2(g)��2H2O(l) ��H����890 kJ/mol
�������ܵó��Ľ�����(�� ��)
A.��Ӧ�ڲ���Ҫ���Ⱦ��ܽ���
B.CO(g)��2H2(g)===CH3OH(g) ��H����90.5 kJ/mol
C.�״���ȼ������H����764 kJ/mol
D.��CO��ȼ������H����283.0 kJ/mol����H2��ȼ������H����285.8 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A����NaOH��Һ��Ӧ��������к��б�������Է�������С��150�����к�̼����������Ϊ70.6%�������������Ϊ5.9%������Ϊ����
��1��A�ķ���ʽ��______��
��2����A����NaHCO3��Һ��Ӧ�ų�CO2���壬��ṹ������______�֡�
��3����A��NaOH��Һ�ڼ���ʱ���ܷ�Ӧ����1mol A����1mol NaOH����A�Ľṹ��ʽ��______��
��4����A��NaOH��Һ�ڼ���ʱ���ܽϿ췴Ӧ����1mol A����2mol NaOH�������������A�Ľṹ������______�֣����в��ܷ���������Ӧ�����ʵĽṹ��ʽ��______��д�����������������Ʒ�Ӧ�Ļ�ѧ����ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��100mLH2S��O2�Ļ�����壬��ȼ��ȫ��Ӧ��ָ���ԭ��״���������Ϊ40mL��������������ȷ���ǣ� ��
A.ʣ��40mL����һ����O2
B.ʣ��40mL������H2S��SO2
C.��������к�H2S40mL��80mL
D.ʣ��40mL������SO2��O2�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ˮ��Һ�д��ڵ���ƽ�⡢ˮ��ƽ�⡢�ܽ�ƽ�⣬��ش��������⡣
��1����֪��������ĵ��볣�����±���
���� | CH3COOH | HCN | H2CO3 |
���볣��(25��) | Ka=1.8��10-5 | Ka=4.3��l0-10 | Ka1=5.0��l0-7 Ka2=5.6��l0-11 |
��0.1moI/LNaCN��Һ��0.1mol/LNaHCO3��Һ�У�c(CN-)__c(HCO3-)(����>������<������=��)��
�ڳ����£����ʵ���Ũ����ͬ��������Һ��A��CH3COONa��B��NaCN��C��Na2CO3����pH�ɴ�С��˳����___(����)��
�۽�����CO2ͨ��NaCN��Һ����Ӧ�����ӷ���ʽ��__��
�������£�����Ũ�ȵ�CH3COONa��ҺpH=9�������ӷ���ʽ��ʾ��Һ�ʼ��Ե�ԭ����__����Һ��![]() =__����д��ȷ��ֵ��
=__����д��ȷ��ֵ��
��2��ij�¶��£�pH=3��������c(OH-��=10-9mol/L�����¶��£�pH=2��H2SO4��pH=11��NaOH��Ϻ�pH��Ϊ9�����������������Ƶ������Ϊ__��
��3�������£���0.100mol/L������Һ�ζ�20.00mL0.l00mol/L��ij��ˮ��Һ���ζ�������ͼ��ʾ��������Ϊ������������
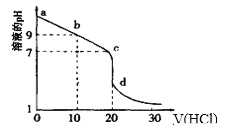
��d����ʾ����Һ������Ũ���ɴ�С��˳������Ϊ__��
��b����ʾ����Һ��c(NH4+)��c(NH3��H2O)=___��
��4����֪Ksp(BaSO4)=1.1��10-10�����ܽ��Ϊ___g��������2λ��Ч���֣�
��5�������£���֪Ksp(Fe(OH)3)=1��10-38����Fe3+��ȫ����ʱ������Һ��pH=___��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com