
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
分析 (1)已知:①Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol-1
②3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol-1
根据盖斯定律,①+②可得:Al2O3(s)+3C(s)═2Al(l)+3CO(g);
(2)①根据v=$\frac{△c}{△t}$计算v(NO);
20min处于平衡常数,平衡时NO浓度为0.5mol/L,N2、CO2的浓度均为0.25mol/L,代入K=$\frac{c(N{\;}_{2})×c(CO{\;}_{2})}{c{\;}^{2}(NO)}$计算平衡常数;
②30minNO、N2、CO2的浓度之比为2:1:1,若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则升高温度平衡逆向移动,正反应为放热反应;
③当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,相对于增大压强,又反应前后的系数不变,所以平衡不移动,NO的转化率不变;
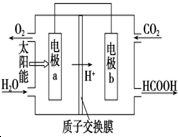
(3)b为正极,是二氧化碳得到电子生成甲酸,据此解答.
解答 解:(1)已知:①Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol-1
②3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol-1
根据盖斯定律,①+②可得:Al2O3(s)+3C(s)═2Al(l)+3CO(g),故△H=(a+b)kJ•mol-1,
故答案为:a+b;
(2)①0~10min内,NO的浓度变化量为(1-0.68)mol/L=0.32mol/L,则v(NO)=$\frac{0.32mol/L}{10min}$=0.032 mol•L-1•min-1;
20min处于平衡常数,平衡时NO浓度为0.5mol/L,N2、CO2的浓度均为0.25mol/L,T1℃时,该反应的平衡常数K=$\frac{c(N{\;}_{2})×c(CO{\;}_{2})}{c{\;}^{2}(NO)}$=$\frac{0.25×0.25}{0.5{\;}^{2}}$=0.25,
故答案为:0.032 mol•L-1•min-1;0.25;
②30minNO、N2、CO2的浓度之比为2:1:1,若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则升高温度平衡逆向移动,正反应为放热反应,故△H<0,故答案为:<;
③a、单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g),都是指逆反应方向,则不能判断达到化学平衡状态,故a错误;
b.该反应前后气体系数不变,所以反应体系的压强一直不变,则反应体系的压强不再发生改变,不能判断达到化学平衡状态,故b错误;
c.反应中有固体参加,反应前后气体的质量在变,而体积不变,所以混合气体的密度一直在变,则当混合气体的密度保持不变,能说明达到化学平衡状态,故c正确;
d.反应中有固体参加,反应前后气体的质量在变,而反应前后气体的物质的量不变,所以混合气体的平均相对分子质量一直在变,则当合气体的平均相对分子质量保持不变,能说明达到化学平衡状态,故d正确;
故答案为:cd;
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,相对于增大压强,又反应前后的系数不变,所以平衡不移动,NO的转化率不变,则反应达平衡时c(NO)=2.50mol/L×$\frac{0.5}{1.0}$=1.25mol/L,故答案为:1.25;不变;
(3)b为正极,是二氧化碳得到电子生成甲酸,电极反应为:CO2+2H++2e-=HCOOH;
故答案为:CO2+2H++2e-=HCOOH.
点评 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡的影响因素分析化学平衡移动原理的应用,平衡常数计算判断,原电池原理和电极反应书写方法,题目难度中等.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:多选题
| A. | 铁丝在空气中燃烧,火星四射,产生红棕色的烟 | |
| B. | 硫在氧气中燃烧发出明亮的蓝紫色火焰 | |
| C. | 在试管中加热铜绿有黑色固体生成 | |
| D. | 人造丝在酒精灯的火焰上灼烧会产生烧焦羽毛的气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作和现象 | 结论 |
| A | 将气体X分别通入溴水和酸性高锰酸钾溶液中,两溶液均褪色 | 气体X一定是C2H4 |
| B | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32--强 |
| C | 向某溶液中先滴加少量氯水,再滴加2滴KSCN溶液,溶液变成血红色 | 原溶液中一定含有Fe2+ |
| D | 将H2S气体通入浓度均为0.01mol•L-l的ZnSO4和CuSO4混合溶液中,先出现CuS黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
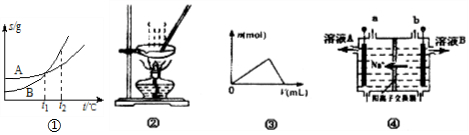
| A. | 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| B. | 用图②所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 图③可以表示向一定量的明矾溶液中逐滴摘加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA | |
| B. | 1L 0.1mol•L-1AlC13中所含Al3+离子数小于0.1NA | |
| C. | 1LpH=1的H2SO4溶液中含有的H+数为0.2NA | |
| D. | 常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(N2)=2.25 mol/L | B. | c(NH3)=1.9 mol/L | C. | c(H2)=0.3 mol/L | D. | c(N2)=1.3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的化学性质比乙烷活泼 | B. | 乙烯的比例模型可表示为  | ||
| C. | 可作香蕉等水果的催熟剂 | D. | 燃烧时火焰明亮,同时产生黑烟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com