
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
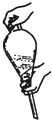
分析 (1)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来,然后向有机层中加入无水MgSO4,出去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可;
(2)环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚和水不互溶,则乙醚能作萃取剂,从而提高产品产量;
(3)A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,应该倒转过来然后用力振荡;
B.放气的方法为:漏斗倒置,打开旋塞放气;
C.经几次振摇并放气后,分液漏斗放置在铁架台上静置待液体分层;
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体;
(4)NaCl能增加水层的密度,降低环己酮的溶解,有利于分层;乙醚的沸点较低,所以蒸馏时温度不宜太高;(5)为防止冷凝管炸裂,应该停止加热;
(6)m(环己酮)=12mL×0.9478g=11.3736g,根据环己醇和环己酮的关系式知,参加反应的m(环己醇)=$\frac{11.3736g}{98g/mol}×100g/mol$=11.6057g,m(环己醇)=20mL×0.9624g/mL=19.248g,据此计算产率.
解答 解:(1)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,水与有机物更容易分离开,然后向有机层中加入无水MgSO4,除去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可,故答案为d b e c a;
(2)环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚和水不互溶,则乙醚能作萃取剂,能将水中的环己酮萃取到乙醚中,从而提高产品产量,
故答案为:使水层中少量的有机物进一步被提取,提高产品的产量;
(3)A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,应该倒转过来然后用力振荡,只有如此才能充分混合,故A错误;
B.放气的方法为:漏斗倒置,打开旋塞放气,而不是打开玻璃塞,故B错误;
C.经几次振摇并放气后,分液漏斗放置在铁架台上静置待液体分层,而不是手持分漏斗静置液体分层
,不符合操作规范性,故C错误;
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,利用压强差使液体流出,再打开旋塞待下层液体全部流尽时,为防止产生杂质,再从上口倒出上层液体,故D错误;
故选ABC;
(4)NaCl能增加水层的密度,降低环己酮的溶解,且有利于分层;乙醚的沸点较低,所以蒸馏时温度不宜太高,所以应该采用水浴加热,
故答案为:降低环己酮的溶解度,增加水层的密度,有利于分层;水浴加热;
(5)如果直接将冷水连接冷凝管,馏分温度如果急剧冷却会导致冷凝管炸裂,为防止冷凝管炸裂,应该停止加热,冷却后通自来水,故答案为:停止加热,冷却后通自来水;
(6)m(环己酮)=12mL×0.9478g=11.3736g,根据环己醇和环己酮的关系式知,参加反应的m(环己醇)=$\frac{11.3736g}{98g/mol}×100g/mol$=11.6057g,m(环己醇)=20mL×0.9624g/mL=19.248g,其产率=$\frac{11.6057g}{19.248g}×100%$=60%(60.3%),
故答案为:60%(60.3%).
点评 本题考查制备实验方案设计,涉及物质的分离提纯、基本实验操作、基本计算等知识点,明确实验原理是解本题关键,同时考查学生获取信息、利用信息解答问题能力,易错点是(3)中基本操作方法.


科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素X与氯形成化合物时,化学式可能是XCl | |
| C. | 元素Y是ⅢA族元素 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与硝酸发生取代反应生成三硝基甲苯 | |
| B. | 甲苯能使热的KMnO4酸性溶液褪色 | |
| C. | 甲苯燃烧时产生带浓烈黑烟的火焰 | |
| D. | 1 mol甲苯最多能与3 mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 香芹酮化学式为C10H14O | |
| B. | 香芹酮可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮能使酸性KMnO4溶液褪色 | |
| D. | 香芹酮分子中有3种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
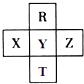 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )| A. | 非金属性:Z<Y<X | |
| B. | R与Y的电子数相差8 | |
| C. | 气态氢化物稳定性:HR<HY<HT | |
| D. | 最高价氧化物的水化物的酸性:HTO4>HYO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
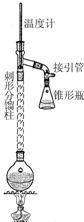 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下: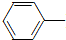 NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$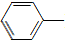 NHCOCH3+H2O
NHCOCH3+H2O| 物质 | 熔点 | 沸点 | 溶解度(20℃) |
| 乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
| 苯胺 | -6℃ | 184.4 | 3.4 |
| 醋酸 | 16.6℃ | 118℃ | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
 3×10-8mol•L-1)
3×10-8mol•L-1)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com