
| A. | X的氢化物的水溶液呈酸性 | |
| B. | Y的氧化物和氢氧化物均不溶于水 | |
| C. | Z的最高价含氧酸的浓溶液有强氧化性 | |
| D. | W原子半径在同周期中最小 |
分析 短周期主族元素X、Y、Z、W的原子序数依次递增,X与Y、Z、W位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍,最外层电子数不超过8个,则X内层电子数是2,所以X位于第二周期,Y、Z、W位于第三周期,Z原子最外层电子数为6,则Z为S元素;Z原子最外层电子数是Y原子最外层电子数的3倍,Y最外层电子数为2,且处于第三周期,Y为Mg元素,四种元素原子的最外层电子数之和为20,所以X、W最外层电子数为20-8=12,只能为ⅤA族、ⅦA族元素,故X为N元素,W为Cl,据此解答.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次递增,X与Y、Z、W位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍,最外层电子数不超过8个,则X内层电子数是2,所以X位于第二周期,Y、Z、W位于第三周期,Z原子最外层电子数为6,则Z为S元素;Z原子最外层电子数是Y原子最外层电子数的3倍,Y最外层电子数为2,且处于第三周期,Y为Mg元素,四种元素原子的最外层电子数之和为20,所以X、W最外层电子数为20-8=12,只能为ⅤA族、ⅦA族元素,故X为N元素,W为Cl.
A.X的氢化物为氨气,氨水溶液呈碱性,故A错误;
B.氧化镁、氢氧化镁均不溶于水,故B正确;
C.Z的最高价含氧酸为硫酸,浓硫酸有强氧化性,故C正确;
D.同周期自左而右原子半径减小,Cl原子半径在同周期中最小,故D正确,
故选A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握核外电子排布,侧重考查分析推断能力、元素化合物知识,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 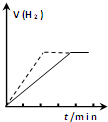 向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,如图虚线表示加入CuSO4溶液时氢气体积与时间的关系 | |
| B. | 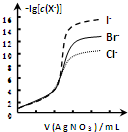 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图曲线,可确定首先沉淀的是Cl- | |
| C. | 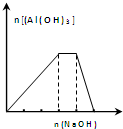 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,图中曲线表示NaOH的物质的量与Al(OH)3物质的量关系图 | |
| D. | 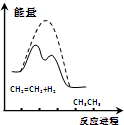 由图可说明乙烯与H2加成反应是放热反应,虚线表示在有催化剂条件下的反应进程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
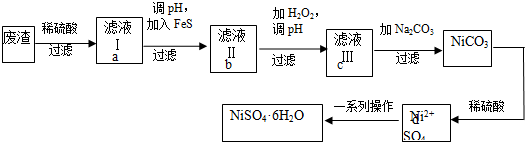
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+)=1.0×10-13mol/L的溶液中,Na+、NH4+、Cl-、SO42- | |
| B. | 滴入甲基橙试液变红色的溶液中:Cl-、AlO2-、HCO3-、NH4+ | |
| C. | 加入少量KSCN后变为红色的溶液中:K+、Mg2+、I-、NO3- | |
| D. | 无色透明的溶液中:CH3COO-、CO32-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中所有原子共平面 | B. | 碳氧原子之间含有1个α键和1个π键 | ||
| C. | 分子中既含单键又含双键 | D. | 分子中既含极性键又含非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
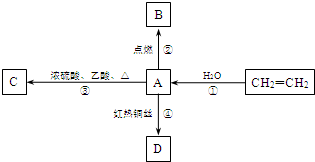 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种转化.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种转化. CH3COOCH2CH3+H2O,该反应的类型是:取代(或酯化)反应.
CH3COOCH2CH3+H2O,该反应的类型是:取代(或酯化)反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com