

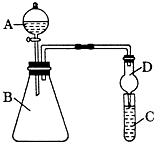
分析 (1)根据实验装置图,A装置是实验室制取氨气的装置,氯化铵与氢氧化钙在加热条件下发生反应生成氯化钙、氨气与水;
(2)实验结束后,关闭止水夹b、c,将装置D浸入冰水中,根据实验装置可知D装置中收集的是干燥的二氧化氮气体,存在平衡 2NO2?N2O4,正向是放热反应,二氧化氮气体是红棕色,四氧化二氮是无色气体,所以放入冰中温度降低,平衡右移,混合气体颜色变浅;
(3)浓硫酸具有吸水性,可以干燥与之不反应的气体,同时吸收过量的氨气;
(4)可以利用浓氨水分解制取氨气或向NaOH或CaO固体上滴加浓氨水制取NH3;
(5)氨气能被无水氯化钙吸收,瓶内压强减小.
解答 解:(1)装置为实验室制氨气的实验装置,目的是制取氨气,化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(2)制得的二氧化氮气体会转化为四氧化二氮,存在化学平衡 2NO2?N2O4,正向是放热反应,二氧化氮气体是红棕色,四氧化二氮是无色气体,所以放入冰中温度降低,平衡右移,混合气体颜色变浅;
故答案为:颜色变浅;
(3)浓硫酸具有吸水性,可以干燥与之不反应的气体,同时吸收过量的氨气;
故答案为:干燥气体,吸收多余的NH3;
(4)实验室制取NH3的一方案有:方案Ⅰ:加热浓氨水制取NH3;
方案Ⅱ:向NaOH或CaO固体上滴加浓氨水制取NH3
故答案为:加热浓氨水制取NH3或向NaOH或CaO固体上滴加浓氨水制取NH3;
(5)正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,氨气被无水氯化钙吸收,压强减小,所以气球膨胀.
故答案为:气球膨胀.
点评 本题以硝酸的制备为背景,考查了氮的化合物的性质,影响化学平衡的因素,同时考查了浓硫酸等物质的性质应用.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 具有相同的质子数 | B. | 具有不同的电子数 | ||
| C. | 这些微粒互称同位素 | D. | 它们是氢元素不同的五种微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 步骤 | 操作 | 现象 |
| 一 | ① | 向试管A中加入2mLFeCl2溶液,滴加少量溴水,振荡 | 溶液变为黄色 |
| ② | 滴加少量KSCN溶液 | 溶液变为红色 | |
| 二 | ① | 向试管B中加入2mL FeCl2溶液和0.5mL苯,将胶头滴管伸入下层溶液,加入约0.5mL稀碘水 | 溶液变为黄色 |
| ② | 滴加少量KSCN溶液 | 溶液没有出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| B. | 可逆反应达到平衡后,正、逆反应速率均为0 | |
| C. | 2 mol SO2 与1 mol O2混合一定能生成2 mol SO3 | |
| D. | 使用催化剂不一定能加大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一样多 | B. | 后者较前者多 | C. | 前者较后者多 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素和化合物性质的递变规律,设计了如下系列实验.
某同学为探究元素和化合物性质的递变规律,设计了如下系列实验.| A中加入物质 | B中加入物质 | C中加入物质 | 实验结论 |
| 稀硫酸或盐酸 | 碳酸钠(或碳酸盐) | 硅酸钠溶液 | 酸性:盐酸>碳酸>硅酸 |
| 氢氧化钠溶液(强碱溶液) | 氯化铵(或铵盐) | 氯化铜溶液(难溶碱的可溶性盐溶液) | 碱性:氢氧化钠>一水合氨>氢氧化铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com