
由短周期元素组成的甲?乙和丙均为中学常见物质,一定条件下,存在转化关系: 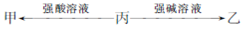
(1)若甲?乙?丙都是单质,甲?乙是同种气体,丙元素的原子结构示意图为 ;丙单质性质活泼,但由其制成的容器可用于储运浓硫酸,原因是 ?工业中制取丙的化学方程式:
(2)若甲?乙是同种有机物,体积分数为75%该有机物的水溶液常用于医疗消毒?写出分子中含有4个碳原子的丙转化为甲的化学方程式:
(3)若甲?乙是不同种气体,乙能使湿润的红色石蕊试纸变蓝?
①写出丙→甲反应的离子方程式: (任写一个)
②0.1mol乙与CuO(s)完全反应,得到一种气态单质?一种固态单质和一种液态化合物,放出14.7kJ的热量?该反应的热化学方程式为 ?
(1) (1分) 冷的浓硫酸能使铝钝化(1分)
(1分) 冷的浓硫酸能使铝钝化(1分) (2分)
(2分)
(2)CH3COOCH2CH3 + H2O 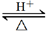 CH3COOH + CH3CH2OH (2分)
CH3COOH + CH3CH2OH (2分)
(3)① HCO3- + H+ = CO2↑+ H2O (或其它合理答案) (2分)
② 2NH3 (g) + 3CuO(s) =" 3Cu(s)" + N2(g)+ 3H2O(l) △H =" -294" kJ·mol-1 (2分)
解析试题分析:(1)丙既可以跟酸反应又可以跟碱反应,由此可知丙为铝,冷的浓硫酸能使铝发生钝化,工业上制取铝,主要是电解熔融的氧化铝。(2)由体积分数为75%该有机物的水溶液常用于医疗消毒可知该物质为乙醇,因此CH3COOCH2CH3 + H2O 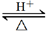 CH3COOH + CH3CH2OH (3)乙能使湿润的红色石蕊试纸变蓝说明乙为氨气,由丙可以与强碱反应生成气体乙氨气,又可以与强酸反应生成气体甲可知,丙应为碳酸氢铵。(4)固态物质是铜单质,气体单质是氮气,液体化合物是水.
CH3COOH + CH3CH2OH (3)乙能使湿润的红色石蕊试纸变蓝说明乙为氨气,由丙可以与强碱反应生成气体乙氨气,又可以与强酸反应生成气体甲可知,丙应为碳酸氢铵。(4)固态物质是铜单质,气体单质是氮气,液体化合物是水.
考点:考查无机物推断的相关知识点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大。A原子无中子, B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等。元素F形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题: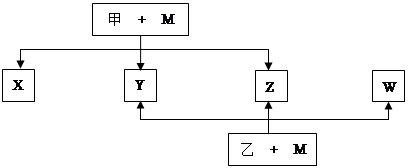
(1)A2D的熔沸点比A2G高的原因是 。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 。
(2)E4B3和水反应的化学方程式 。
(3)写出M与甲的浓溶液加热时反应的化学方程式 。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(5)已知CH4 (g)+ 2O2(g)=CO2 (g)+2H2O(l) △H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O(l)的焓变△H2 ,则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 =" b" kJ/mol,则该反应的热化学方程式为 。
据此计算出△H2 = kJ/mol(用含a和b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生铁中一般含有化合物B,B只有两种元素组成,它的含量、形状、分布对生铁性能影响很大,使生铁硬而脆,不宜进行机械加工。已知:(1)E、F、H、I、P常温下为气体,H、I、P为单质,E是一种红棕色气体。(2)反应①②均为制备理想的绿色水处理剂Na2FeO4的方法,其中反应①在生成Na2FeO4同时还生成NaNO2和H2O。各物质之闻的转化关系如下图所示f图中部分生成物没有列出)。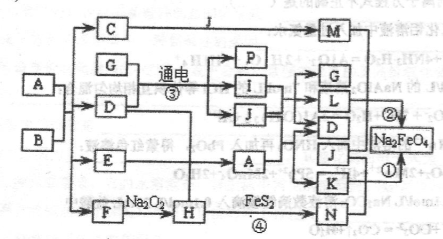
请填写以下空白:
(1)用电子式表示F的形成过程_________________________________________
(2)按要求完成下列反应:__________________________________________
反应③的离子方程式为________________________________________
反应①的化学方程式为________________________________________
(3)反应②中氧化剂与还原剂的物质的量比为__________________________________
反应④中的氧化产物的化学式为_______________________________________
(4)实验室中检验C溶液中金属阳离子的常用方法是________________________
(5)如果A与B反应时生成E与F的物质的量比为13:1,则化合物B的化学式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知通常状况下甲、乙、丙、丁等为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③都是重要的化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。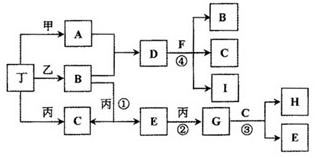
请回答下列问题:
(1)反应④的化学方程式为: ________________________。
(2)B和E在一定条件下可发生反应,这是一个具有实际意义的反应,可消除E对环境的污染,该反应氧化产物与还原产物的物质的量之比为________。
(3)0.1mol lL-1A溶液和0.1mol ?L-1B溶液等体积混合,溶液呈________性,原因是(用离子方程式说明) ________________。
(4)请设计实验检验D晶体中的阳离子(简述实验操作、现象和结论):________________。
(5)pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是(用A、D、H表示) : ____________。
(6)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol? L-1 A的溶液100 mL,恰好使混合物全部溶解,且放出336mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取同质量的Fe、FeO、Fe3O4混合物,加入1 mol ? L-1 H的溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的H溶液的体积是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。常温常压下,化合物A是家庭生活中常用的一种调味品,A、C的焰色反应都呈黄色,8是无色无味的液体,D是黄绿色气体,E、F都是无色气体,F的水溶液是盐酸,H的水溶液具有漂白、杀菌性,J在水溶液中生成时为红褐色沉淀。
(1)H的化学式为 。
(2)F的电子式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应中,反应后固体物质增重的是
| A.氢气通过灼热的CuO粉末 | B.二氧化碳通过Na2O2粉末 |
| C.铝与Fe2O3发生铝热反应 | D.将锌粒投入Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为除去括号内的杂质,所选用的试剂或方法不正确的是
| A.NaHCO3溶液(Na2CO3溶液) 通入过量的CO2 |
| B.铁粉(铝粉) 加入适量的NaOH溶液过滤 |
| C.Na2CO3溶液(Na2SO4溶液) 加入适量的Ba(OH)2溶液过滤 |
| D.CO2 (CO) 将混合气体通过足量灼热的CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学在工业生产和日常生活中都有着重要的应用,下列说法正确的是
| A.活性炭、SO2、氯水都会因发生氧化还原反应而使品红溶液褪色 |
| B.Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| C.常温下,浓硫酸、浓硝酸与铝均能发生钝化,均能用铝罐储运 |
| D.水玻璃,从分类法的角度,可看作纯净物,可用于木材等的防火剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com